
科目: 来源: 题型:
【题目】100℃时,在1 L恒温恒容的密闭容器中,通入0.1molN2O4,发生反应:N2O4(g)![]() 2NO2(g) ΔH=+57.0kJ·mol-1,NO2和N2O4的浓度随时间变化情况如图所示。
2NO2(g) ΔH=+57.0kJ·mol-1,NO2和N2O4的浓度随时间变化情况如图所示。

Ⅰ.(1)在0~60 s内,以N2O4表示的平均反应速率为____mol·L-1·s-1。
(2)根据图中有关数据,计算100℃时该反应的平衡常数K1=____。若其他条件不变,升高温度至120℃,达到新平衡时的平衡常数是K2,则K1_____K2(填“>”、“<”或“=”)。
(3)反应进行到100s时,若只有一项条件发生变化,则变化的条件可能是____。
A.降低温度 B.通入氦气 C.又往容器中充入N2O4 D.增大容器容积
(4)已知:N2(g)+2O2(g)![]() 2NO2(g) ΔH=+67.2kJ·mol-1
2NO2(g) ΔH=+67.2kJ·mol-1
N2H4(g)+O2(g)![]() N2(g)+2H2O(g) ΔH=-534.7kJ·mol-1
N2(g)+2H2O(g) ΔH=-534.7kJ·mol-1
N2O4(g)![]() 2NO2(g) ΔH=+57.0kJ·mol-1
2NO2(g) ΔH=+57.0kJ·mol-1
则2N2H4(g)+N2O4(g)![]() 3N2(g)+4H2O(g) ΔH=____kJ·mol-1。
3N2(g)+4H2O(g) ΔH=____kJ·mol-1。
Ⅱ.向容积为2 L的密闭容器中通入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。
H2(g)+CO2(g)。
(5)下列说法能作为判断该反应达到化学平衡状态的依据的是____(填字母序号)。
A.容器内CO、H2O、CO2、H2的浓度之比为1∶1∶1∶1
B.CO的消耗速率与H2的消耗速率相等
C.容器内压强保持不变
D.混合气体的密度保持不变
(6)保持其他条件不变:
①若向平衡体系中再通入0.20molH2O(g),平衡将___(填“向右”、“向左”或“不”)移动,达到新的平衡状态后,H2O(g)的体积分数将____(“变大”、“变小”或“不变”);
②在VL密闭容器中通入10molCO和10molH2O(g)发生上述反应,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时其他各成分的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO的燃烧热为283kJ·mol-1,H2的燃烧热为286kJ·mol-1),则T℃平衡常数K=____。(精确到小数点后两位)
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在2 L的密闭容器中,加入1mol X(g)和2 mol Y(g)发生反应:X(g)+mY(g)![]() 3Z(g) ΔH<0,平衡时,X和Y的转化率都是10%。下列叙述不正确的是
3Z(g) ΔH<0,平衡时,X和Y的转化率都是10%。下列叙述不正确的是
A.m=2
B.达平衡时,Z的体积分数为10%
C.达平衡后,保持容器体积不变,加热,容器内压强将增大
D.将平衡后的容器体积压缩至1L,X的浓度为0.45mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液可能含OH-、SO42-、HCO3-、Cl-、Ba2+和Na+。探究小组为了确定该溶液中离子的组成,取该溶液100mL进行以下实验:
(1)填写下表空格
实验操作与现象 | 实验结论 | 判断理由 | |
步骤一 | 加入过量HCl溶液,有气泡产生; | 肯定有___、肯定无___。 | HCO3-与OH-不共存 |
步骤二 | 步骤一中得到标况下的气体22.4L; | HCO3-的物质的量浓度为___mol/L | C元素守恒 |
步骤三 | 向上述滤液中加足量Ba(NO3)2溶液,经过滤得到46.6g不溶于稀硝酸的沉淀。 | 肯定有___、___;肯定无___。 | 溶液显电中性;SO42-与Ba2+不共存会产生白色沉淀。 |
(2)步骤三过滤所需玻璃仪器有:烧杯、___、___。
(3)步骤一产生气泡的离子方程式为___,步骤三生成沉淀的离子方程式为:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】有一包白色固体粉末,由FeCl3、CaCO3、Na2SO4、KCl、Ba(NO3)2中的几种物质组成,取样品进行如下实验(假设下列过程中,能反应的物质之间的反应恰好完全):

(1)步骤①所用分离方法叫做___,要从步骤②所得“无色溶液”中提取溶剂,所用分离方法叫做___。
(2)写出实验过程中发生化学反应的离子方程式①___;②___。
(3)固体粉末中一定不存在的物质是(填化学式,下同)___;不能确定是否存在的物质是___。
(4)将固体粉末可能的组成填入下表(可以不填满,也可以再补充)。___
序号 | 化学式 |
Ⅰ | |
Ⅱ | |
(5)设计一个实验,进一步确定混合物的组成,简述实验操作、现象和结论。___
查看答案和解析>>
科目: 来源: 题型:
【题目】CR-39树脂是应用最广泛的生产普通树脂镜片的材料。用乙烯合成CR-39树脂单体的过程如图:
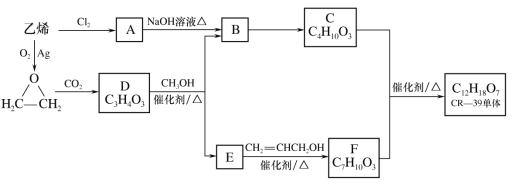
已知:RCOOR’+R”OH![]() RCOOR”+R’OH(R、R’、R”代表烃基)
RCOOR”+R’OH(R、R’、R”代表烃基)
(1)乙烯的电子式为___。
(2)A转化为B的反应类型是____。
(3)D为五元环状化合物且分子中只有一种化学环境的氢原子。D与CH3OH反应的化学方程式是___。
(4)E的一种同分异构体G,其分子中不同化学环境的氢原子个数比是3∶1∶1∶1,且能与NaHCO3反应。
①G与NaOH溶液发生中和反应的离子方程式是____。
②G在一定条件下缩聚生成高分子化合物的结构简式是___。
(5)下列有关C和F的叙述正确的是(填写序号)___。
a.C能与乙酸发生酯化反应
b.C的同分异构体能发生银镜反应
c.F分子中含有三种官能团
d.1molF最多能与2molNaOH反应
(6)CR-39单体的结构简式是:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组探究清洗试管(内壁附着银镜)的反应原理,进行下列实验。
I.初步探究
(1)将稀硝酸加入附着银镜的试管中,记录现象如下:
实验Ⅰ | 实验操作 | 实验现象 |
| 银镜上出现气泡,在液面下方为无色气体,在试管口附近......;试管内壁上的银逐渐溶解。 |
①补全反应中的实验现象___。
②实验Ⅰ中银镜消失发生反应的化学方程式为____。
(2)为消除实验Ⅰ中氮氧化物的污染,将双氧水溶液加入附着银镜的试管中。
实验Ⅱ | 实验操作 | 实验现象 |
| 剧烈反应,有大量无色气体产生,该气体可以使带火星的木条复燃;试管内壁上的银逐渐溶解。 |
①由现象推测H2O2将Ag氧化为Ag+,但通过实验排除了这种可能。该实验方案是:在反应后的液体中,加入___。
②查阅资料发现:该实验中银镜溶解后最终产物为颗粒很小(直径在1~100nm之间)的Ag,其分散在液体中,肉眼无法识别。该同学通过实验证实了这种可能性。他的操作及现象是:___。
③写出该实验Ⅱ中发生反应的化学方程式:___。
II.查阅资料,继续探究
查阅文献:Ag2O+4NH3H2O=2[Ag(NH3)2]++2OH-+3H2O
(3)探究Ag2O在H2O2分解反应中的作用,进行如下实验。
实验Ⅲ | 实验操作 | 实验现象 |
| 剧烈反应,产生大量的无色气体,同时在试管底部仍有少量黑色固体 |
根据实验Ⅲ的现象猜想:Ag2O在反应中作氧化剂。继续实验,在实验Ⅲ反应后的试管中加入足量的溶液x后,固体仍有剩余。由此验证了该猜想的正确。
①在实验中加入足量的溶液x是____。
②实验Ⅲ中发生反应的化学方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础。如图为两套实验装置。

(1)写出下列实验仪器的名称A___;B___;C__;D___。
(2)用装置1分离四氯化碳和Br2的混合物,实验操作的名称为___,冷凝管的进水口是___;(填a或b);
(3)现需配制480mL 0.2mol/L KOH溶液,需要称量KOH___g,配制过程中所用到的仪器有托盘天平、烧杯、___、___、胶头滴管。
(4)装置2是某同学转移溶液的示意图,图中的错误是___。
(5)下列操作会引起浓度偏高的是___。
A.溶液未冷却到室温就转移至容量瓶中 B.称量固体时将右边放药品与左边放砝码
C.定容时仰视读数 D.容量瓶中的水未除尽
查看答案和解析>>
科目: 来源: 题型:
【题目】合理利用资源成为当今研究热点。CH3NH2、PbI2及HI常用作合成太阳能电池的敏化剂甲胺铅碘(CH3NH3PbI3)的主要原料。
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | E1 | E2 | E3 | E4 |
则上述热化学方程式中ΔH=___kJ·mol-1。
(2)可利用水煤气合成上述反应所需甲醇。反应为CO(g)+2H2(g)![]() CH3OH(g)ΔH<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g)ΔH<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
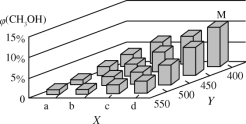
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为___。
②图中Y轴表示温度,其判断的理由是__。
(3)可利用四氧化三铅和氢碘酸反应制备难溶PbI2,若反应中生成amolPbI2,则转移电子的物质的量为___。
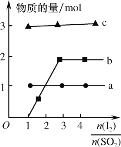
(4)将二氧化硫通入碘水制备HI的反应曲线如图所示,其反应原理为:SO2+I2+2H2O=3H++HSO4-+2I-,I2+I-![]() I3-,图中曲线a、b分别代表的微粒是__和__(填微粒符号);由图知要提高碘的还原率,除控制温度外,还可以采取的措施是___。
I3-,图中曲线a、b分别代表的微粒是__和__(填微粒符号);由图知要提高碘的还原率,除控制温度外,还可以采取的措施是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】据报道,以硼氢化合物NaBH4(B元素的化合价为+3)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。下列说法正确的是( )
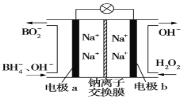
A.电池放电时Na+从b极区移向a极区
B.电极b采用MnO2,MnO2既作电极材料又有催化作用
C.每消耗1molH2O2,转移的电子为1mol
D.该电池的正极反应为:BH4-+8OH--8e-=BO2-+6H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求完成下列问题。
(1)写出下列物质在水溶液中的电离方程式:
H2SO4:___ Ba(OH)2:____
Al2(SO4)3:___ NaHSO4:______
NaHCO3:___
(2)根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①用“双线桥法”标出下列氧化还原反应电子转移情况。___。
②还原剂是___,氧化产物是___。
③氧化剂与还原产物的物质的量之比为___。当生成2mol的NO2时,转移电子物质的量为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com