
科目: 来源: 题型:
【题目】下列四有机物存在如图所示的转化关系,有关说法错误的是( )

A.有机物①最多有9个原子共平面
B.有机物②可以发生取代反应、加成反应和加聚反应
C.有机物③和有机物④互为同分异构体
D.有机物①②③④都能使酸性KMnO4溶液褪色,都有漂白性
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.NaHS的水解:HS-+ H2O![]() S2-+ H3O+
S2-+ H3O+
B.NaHCO3在水溶液中的电离:HCO3+ H2O![]() H2 CO3+ OH
H2 CO3+ OH
C.NH4Cl的水解:NH4+ + H2O = NH3·H2O + OH
D.硫酸铝溶液和碳酸氢钠溶液混合: Al3+ + 3HCO3 = Al(OH)3↓+3CO2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】我国有较多的科研人员在研究甲醛的氧化,有人提出HCHO(![]() )与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程示意图如图(图中只画出了HAP的部分结构)。
)与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程示意图如图(图中只画出了HAP的部分结构)。

下列说法正确的是( )
A.该反应的氧化产物是CO2
B.HCHO在反应过程中有C=O键发生断裂
C.根据图示信息,CO2分子中的氧原子全部来自O2
D.HAP能提高HCHO与O2应的活化能,但不改变反应路径
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化硅又称硅石,是制备硅及含硅化合物的重要原料。部分转化过程如图所示,下列说法正确的是
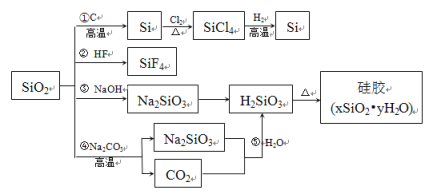
A.SiO2既能发生②反应,又能发生③反应,说明SiO2属于两性氧化物
B.④反应是水泥工业的化学反应原理之一,⑤反应可证明H2CO3酸性强于H2SiO3
C.①反应的生成物除Si外还有CO2,硅胶可用作催化剂的载体
D.除了粗硅的制备和提纯过程中涉及的反应外,图中所示其他反应都是非氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】碲(52Te)被誉为“国防与尖端技术的维生素”;锡酸钠可用于制造陶瓷电容器的基体,陶瓷电容器在宇航、导弹、航海等方面有着重要的用途。以锡碲渣(主要含Na2SnO3和Na2TeO3)为原料,制备锡酸钠和碲的流程图如图:
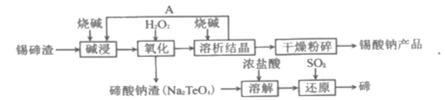
已知:锡酸钠(Na2SnO3)和亚碲酸钠(Na2TeO3)均易溶于碱。
(1)在生产过程中,要将锡碲渣粉碎,其目的是___。
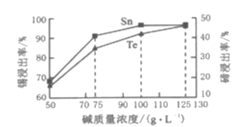
(2)“碱浸”过程中,锡碲浸出率与溶液中碱的质量浓度关系如图所示,最理想的碱的质量浓度为100g/L,其理由是___。
(3)“氧化”时,反应的离子方程式为___;“氧化”的温度控制在60℃~70℃之间,其原因是___。
(4)“还原”反应的化学方程式为___。
(5)以石墨为电极电解Na2TeO3溶液可获得Te,电解过程中阴极上的电极反应为___。
(6)常温下,向lmolL-1Na2TeO3溶液中滴加盐酸,当溶液中c(TeO32-):c(H2TeO3)=0.2时,pH=___。(已知:H2TeO3的电离平衡常数Ka1=1.0×10-3,Ka2=2.0×10-8)
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。用氧化还原滴定法测定TiO2的质量分数,取17.2gTiO2样品在一定条件下溶解并还原为Ti3+,将溶液加水稀释配成250mL溶液;取出25.00mL该溶液于锥形瓶中,滴加KSCN溶液作指示剂,用0.5mol/L的NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。请回答下列问题:
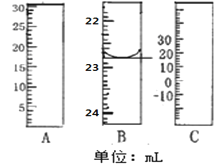
(1)如图分别是温度计、量筒、滴定管的一部分,其中A仪器的名称为________B的正确读数为________。
(2)TiCl4水解生成TiO2xH2O的化学方程式为________。
(3)判断滴定终点的现象是_____________。
(4)滴定到达终点时,共用去0.5mol/L的NH4Fe(SO4)2标准溶液40.00mL,则原样品中TiO2质量分数______________。
(5)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果________。
②若在滴定终点读取滴定管读数时,俯视标准液液面,使测定结果__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示。则该溶液中Fe2(SO4)3与CuSO4的物质的量浓度之比为
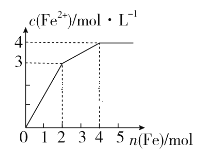
A.3∶1B.1∶2C.2∶1D.1∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】已知亚磷酸(H3PO3)的结构如图![]() ,具有强还原性的二元弱酸,可以被银离子氧化为磷酸。
,具有强还原性的二元弱酸,可以被银离子氧化为磷酸。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的方程式___;
(2)Na2HPO3是________(填“正盐”或“酸式盐”);
(3)亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为______________;
(4)某温度下,0.10molL-1的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2molL-1,该温度下H3PO3的一级电离平衡常数Ka1=______;(H3PO3第二步电离忽略不计,结果保留两位有效数字)
(5)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:c(Na+)_____c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”);
(6)向某浓度的亚磷酸中滴加NaOH溶液,其pH与溶液中的H3PO3、H2PO3—、HPO32—的物质的量分数a(X)(平衡时某物种的浓度与整个物种浓度之和的比值)的关系如图所示。
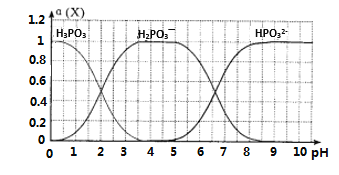
以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡 常数(25℃) | Ka=1.77×10-4 | Ka=4.0×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)室温下①0.1mol·L-1HCOONa;②0.1mol·L-1NaClO;③0.1mol·L-1Na2CO3;④0.1mol·L-1NaHCO3四种溶液的pH由大到小的关系为________________。(用序号填空)
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为________________。
(3)下列离子方程式正确的是___________(填字母)。
A.2ClO-+H2O+CO2=2HClO+CO32- B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.H2SO3+2HCOO-=2HCOOH+SO32- D.Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-
(4)某温度(T℃)下的溶液中,c(H+)=10-xmol·L-1,c(OH-=10-ymol·L-1,x与y的关系如图所示。

①此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为_______。
②在此温度下,0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1mol·L-1的Ba(OH)2 | 10 | 10 | 10 | 10 |
0.1mol·L-1的NaHSO4 | 5 | 10 | 15 | 20 |
按甲方式混合后,所得溶液的pH为____________;
按乙方式混合后,其反应的离子方程式:_________________。
按丁方式混合后,所得溶液显____________(填“酸”“碱”或“中”)性
查看答案和解析>>
科目: 来源: 题型:
【题目】有以下物质:①石墨;②氯化氢气体;③酒精;④氨水;⑤二氧化碳;⑥碳酸氢钠固体;⑦氯化铁溶液;⑧纯醋酸;⑨氧化钠固体;⑩铝。
(1)属于非电解质的是______________;属于强电解质的是__________;属于弱电解质的是___________。(用序号填空)
(2)写出物质⑥溶于水溶液显碱性的原因_______(用离子方程式和简要文字说明作答)
(3)写出物质⑥和⑧在水中反应的离子方程式:_____________。
(4)配制溶液⑦时通常将⑦先溶于___________,然后再加水稀释,通过增加溶液中_______的浓度以防止其发生水解。
(5)浓度、体积相同的②和⑧的溶液,加入相同形状且足量的Zn粒,反应速率快的是___(用序号填空);pH值、体积相同的②和⑧的溶液时,产生气体的量多的是________。(用序号填空)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com