
科目: 来源: 题型:
【题目】如图是喷泉实验装置图,下列说法不正确的是
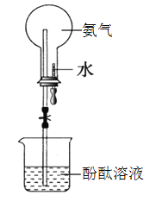
A.烧瓶中的溶液呈红色
B.该实验说明氨气可电离产生OH-
C.该实验说明氨气易溶于水
D.形成喷泉的原因是烧瓶内压强小于外界大气压
查看答案和解析>>
科目: 来源: 题型:
【题目】我国高校目前联合研究一种稀土制冷材料,其主要成分是LaCaMnO.
(1)猛原子的基态价层电子排布式为__.
(2)S与O为同主族元素,其中电负性较大的是__; H2S分子中S原子杂化轨道类型为__;试从结构角度解释H2SO4的酸性大于H2SO3的酸性:__.
(3)据报道,Ca在空气中点燃生成CaO和少量Ca2N2.
①Ca2N2和水反应生成NH2﹣NH2,NH2﹣NH2能否作配体?__(填“能”或“否”)
②CaO形成的晶体与NaCl晶体一样,为面心立方最密堆积,则一个CaO晶胞中含 有Ca2+数为__;欲比较CaO与NaCl的晶格能大小,需考虑的数据是__.
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活密切相关。
I.K2Cr2O7曾用于检测司机是否酒后驾驶:Cr2O72-(橙色)+CH3CH2OH→Cr3+(绿色)+CH3COOH(未配平)
(1)基态Cr原子的价电子轨道表达式为__。
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为__,碳原子的轨道杂化类型为__,所含σ键与π键的数目之比为__。
(3)已知Cr3+等过渡元素水合离子的颜色如表所示:
离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因为__。
II.ZnCl2浓溶液常用于除去金属表面的氧化物,例如与FeO反应可得Fe[Zn(OH)Cl2]2溶液。
(4)Fe[Zn(OH)Cl2]2溶液中不存在的微粒间作用力有__(填选项字母);
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力 F.氢键
溶液中[Zn(OH)Cl2]-的结构式为__。
III.锌是人体必需的微量元素之一,其堆积方式如图1,晶胞结构如图2。
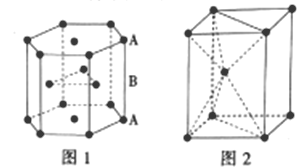
(5)锌的堆积方式为__,配位数为__。
(6)若锌原子的半径为apm,阿伏加德罗常数的值为NA,则锌晶体的密度为___g/cm3(用含a的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】瑞典化学家舍勒在研究软锰矿矿石时,把浓盐酸和软锰矿矿石混合加热,意外得到了氯气,MnO2 + 4HCl(浓)![]() MnCl2 + Cl2 ↑+ 2H2O 关于该反应的叙述不正确的是
MnCl2 + Cl2 ↑+ 2H2O 关于该反应的叙述不正确的是
A.MnO2是氧化剂B.HCl具有还原性
C.MnO2被HCl还原D.氧化剂与还原剂的物质的量之比为1:4
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,⑦(NH4)2SO4,⑧乙醇中,由极性键形成的非极性分子有_______(填序号,以下同),含有金属离子的物质是__,分子间可形成氢键的物质是________,属于离子晶体的是__,属于原子晶体的是__,①~⑤五种物质的熔点由高到低的顺序是__。
(2)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500 ℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__。
(3)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A.__;B.__;C.__D.____。
.
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究H2O2、SO2、Br2的性质,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。
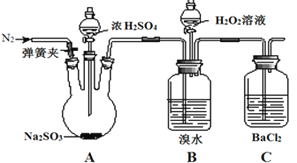
实验操作 | 实验现象 |
i.打开弹簧夹,通入N2一段时间,关闭弹簧夹,打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
ⅱ.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
ⅲ.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(1)在滴入浓硫酸之前要通入N2一段时间的目的是__________________________。
(2)该实验可以证明SO2具有_________性;H2O2的氧化性_________Br2(填“强于”“弱于”)。
(3)B中红棕色褪去的原因_______________________________,B中重新变成红棕色的原因____________________________________(均用离子方程式表示)。
(4)C中产生的白色沉淀是______。
(5)甲同学通过C中产生白色沉淀,得出结论:SO2能与BaCl2反应产生沉淀。乙同学认为不能得出此结论,并对实验进行了改进:在B和C之间增加盛放_________的洗气瓶。再次进行实验时,则C中未产生沉淀。
(6)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:
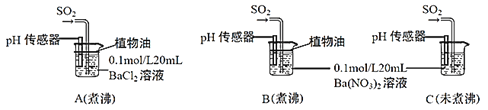
①实验A中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,原因是__________________。(用化学方程式表示)
②实验C中出现白色沉淀比实验B快很多。由此得出的结论是__________________。若实验B、C中通入足量的SO2后,溶液酸性:B_________C(填“强于”“弱于”“等于”)。
(7)Na2SO3固体因贮放不慎发生变质。现取样品1.8克溶于水得溶液A,在A中加入足量BaCl2溶液,过滤得沉淀B,将沉淀B加入足量的稀硫酸后,沉淀不仅不消失,反而增加了0.16g(假如沉淀完全转化)。样品中Na2SO3的质量分数是___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
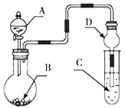
A.若A为浓盐酸,B为Na2CO3,C中盛有Na2SiO3溶液,则C中溶液出现白色沉淀,证明酸性:H2CO3> H2SiO3
B.若A为浓盐酸,B为KMnO4,C中盛石蕊试液,则C中溶液最终呈红色
C.若A为较浓硫酸,B为Na2SO3固体,C中盛有Na2S溶液,则C中溶液变浑浊
D.装置D起干燥气体作用
查看答案和解析>>
科目: 来源: 题型:
【题目】已知镓是铝同族下一周期的元素。砷化镓的晶胞结构如图所示。试回答:
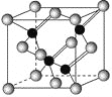
(1)镓的基态原子的电子排布式是______。
(2)砷化镓晶胞中所包含的砷原子(白色球)个数为___,与同一个镓原子相连的砷原子构成的空间构型为____。
(3)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是___ (用氢化物分子式表示)。
(4)砷化镓可由(CH3)3Ga和AsH3在700 ℃时制得。(CH3)3Ga中镓原子的杂化方式为____。
(5)比较二者的第一电离能:As____Ga(填“<”、“>”或“=”)。
(6)下列说法正确的是__(填字母)。
A.砷化镓晶胞结构与NaCl相同 B.电负性:As>Ga C.砷化镓晶体中含有配位键
查看答案和解析>>
科目: 来源: 题型:
【题目】三氟化氮(NF3)是无色无味的气体,它可由氨和氟直接反应得到:4NH3+3F2![]() NF3+3NH4F。下列有关NF3的叙述正确的是
NF3+3NH4F。下列有关NF3的叙述正确的是
A. NF3是离子化合物 B. NF3中的N呈+3价
C. NF3的氧化性比F2强 D. NF3的还原性比NH3强
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,将充满NO2和O2的试管倒立于水槽中,充分反应后,剩余气体的体积为原混合气体体积的![]() ,则原混合气体中NO2和O2的体积之比是
,则原混合气体中NO2和O2的体积之比是
A.8:1B.7:3C.1:7D.4:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com