
科目: 来源: 题型:
【题目】在两只锥形瓶中分别加入浓度均为l molL-1 的盐酸和NH4Cl溶液,将温度和pH 传感器与溶液相连,往瓶中同时加入过量的质量、形状均相同的镁条,实验结果如下图。关于该实验的下列说法,正确的是

A.P点溶液:c(NH4+) + 2c(Mg2+) >c(Cl-)
B.反应剧烈程度:NH4Cl >HCl
C.Q点溶液显碱性是因为MgCl2发生水解
D.1000s后,镁与NH4Cl溶液反应停止
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,将pH均为2 的HCl与HX 的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法不正确的是
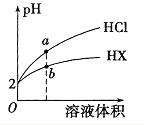
A. a、b两点: c(X-) < c(Cl-) B. 溶液的导电性: a < b
C. 稀释前,c(HX) > 0.01mol/L D. 溶液体积稀释到10倍,HX 溶液的pH < 3
查看答案和解析>>
科目: 来源: 题型:
【题目】已知: ①1mol晶体硅中含有2molSi-Si键。②Si(s)+O2(g)=SiO2(s)ΔH,其反应过程与能量变化如图所示。
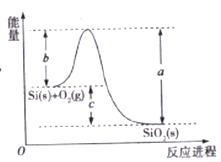
③
化学键 | Si-O | O=O | Si-Si |
断开1mol共价键所需能量/KJ | 460 | 500 | 176 |
下列说法正确的是
A. 晶体硅光伏发电是将化学能转化为电能的
B. 二氧化硅稳定性小于硅的稳定性
C. ΔH=-988 kJ/mol
D. ΔH=a-c
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下发生反应:3A(g)+2B(g) ![]() xC(g)+2D(g),在2 L密闭容器中,把4 mol A和2 mol B混合,2 min后达到平衡时生成1.6 mol C,又测得反应速率vB=0.2 mol·L-1·min-1,则下列说法中正确的是( )
xC(g)+2D(g),在2 L密闭容器中,把4 mol A和2 mol B混合,2 min后达到平衡时生成1.6 mol C,又测得反应速率vB=0.2 mol·L-1·min-1,则下列说法中正确的是( )
A. x=3B. B的转化率为20%
C. 平衡时气体压强是原来的0.94倍D. 达到平衡时A的浓度为1.4 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是以秸秆(含多糖类物质)为原料合成聚酯类高分子化合物的路线:

已知:
请回答下列问题:
食物中的纤维素虽然不能为人体直接提供能量,但能促进肠道蠕动,黏附并带出有害物质,俗称人体内的“清道夫”。从纤维素的化学成分看,它是一种____(填序号)。
a.单糖 b.多糖 c.氨基酸 d.脂肪
A中官能团的名称为____、____。
A生成B的反应条件为____。
B、C的结构简式分别为____、____。
写出E→F的化学反应方程式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学小组学生利用如图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl36H2O晶体。(图中夹持及尾气处理装置均已略去)

(1)装置B中发生反应的化学方程式是______。
(2)装置E中的现象是______。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。写出可能发生的有关反应化学方程式:______。
(4)该小组学生利用上述滤液制取FeCl36H2O晶体,设计流程如图所示:
![]()
①步骤I中通入Cl2的作用是________。
②简述检验滤液中Fe3+的操作方法_______。
③步骤Ⅱ从FeCl3稀溶液中得到FeCl36H2O晶体的主要操作包括:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。
一定条件下,在2L密闭容器内,反应2NO2![]() N2O4,n(NO2)随时间变化如表:
N2O4,n(NO2)随时间变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
用NO2表示0~2s内该反应的平均反应速率___。在第5s时,NO2的转化率为___。根据表中可以看出,随着反应进行,反应速率逐渐减小,其原因是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】铅酸蓄电池价格低廉,原材料易得,适用范围广。其放电时的反应原理为:
Pb+PbO2+2H2SO4===2PbSO4+2H2O。

(1) 写出铅酸蓄电池放电时正极的电极反应式:________,放电时,H+向电池______极定向移动(填“正”或“负”)。
(2) 传统的铅酸蓄电池在充电末期,电极上会产生O2,为了避免气体逸出形成酸雾腐蚀设备,科学家发明了密封铅蓄电池(VRLA),采用阴极吸收法达到密封效果。其原理如图所示,则O2在阴极被吸收的电极反应式为________。
(3) 铅的电解精炼是工业上实现废铅回收以及粗铅提纯的重要手段。铅的电解精炼在由PbSiF6和H2SiF6两种强电解质组成的水溶液中进行。从还原炉中产出的某粗铅成分如下表所示:
成分 | Pb | Cu | Ag | Fe | Zn | Sn | 其它 |
% | 97.50 | 1.22 | 0.12 | 0.15 | 0.09 | 0.64 | 0.28 |
①电解精炼时阳极泥的主要成分是________(元素符号)。
②电解后阴极得到的铅中仍含有微量的杂质,该杂质最有可能是________(填一种)。
③电解过程中,粗铅表面会生成SiF6气体,写出该电极反应式________。
查看答案和解析>>
科目: 来源: 题型:
【题目】NA 表示阿伏加德罗常数的值。下列关于1 L 0. lmo/L FeCl3溶液的说法中正确的是
A.加热煮沸至溶液呈红褐色时,得到0. 1 NA Fe( OH)3 胶体粒子
B.室温下,加水稀释后,溶液中 c(OH- ) 减小
C.加入0. 3 mol KSCN 溶液,生成0. 1 mol Fe(SCN)3 的红色物质
D.加入0. 15 mol NaOH 固体后 ,3c( Fe3 + ) +c(H+) =c(Na+) +c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com