
科目: 来源: 题型:
【题目】(某混合物甲中含有明矾[KAl(SO4)2·12H2O]、Al2O3和Fe2O3。在一定条件下由甲可实现如图所示的物质之间的转化:

请回答下列问题:
(1)写出A、B的化学式:A___,B___。
(2)试剂a最好选用下列试剂中的(______)
A.NaOH溶液 B.稀盐酸 C.二氧化碳 D.氨水
写出相应的离子方程式___。
(3)写出反应②(生成溶液C和沉淀)的离子方程式___。
(4)固体D可以作为复合性的化学肥料,D中所含物质的化学式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.010mol/L的NaOH溶液滴定10.00mL 0.010mol/L的酸H2A,滴定过程中加入NaOH溶液的体积(V)与溶液中lg![]() 的关系如图所示(10mL之后的曲线未画出)。下列叙述正确的是( )
的关系如图所示(10mL之后的曲线未画出)。下列叙述正确的是( )
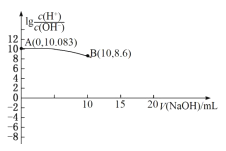
A.H2A![]() H++HA-
H++HA-
B.Ka(HA-)的数量级为10-5
C.滴定过程中,水的电离程度最大的为B点溶液
D.V(NaOH)=15mL时的溶液中:c(Na+)>c(A2-)>c(HA-)
查看答案和解析>>
科目: 来源: 题型:
【题目】在Na+浓度为0.5mol·L-1的某澄清溶液中,还可能含有下表中的若干种离子。
阳离子 | K+ Ag+ Mg2+ Ba2+ |
阴离子 | NO3- CO32- Cl- SO42- |
现取该溶液100mL进行如下实验(气体体积均在标准状况下测定)。
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀硝酸 | 放出标准状况下0.56L无色气体 |
Ⅱ | 向Ⅰ的反应混合液中加入过量的硝酸钡,产生白色沉淀,对沉淀洗涤、干燥,称量所得固体质量 | 固体质量为9.32克 |
Ⅲ | 向Ⅱ的滤液中滴加硝酸银溶液 | 无明显现象 |
请回答下列问题。
(1)实验Ⅰ能确定一定不存在的离子是___。
(2)实验Ⅰ中生成气体的离子方程式为___。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)。___
阴离子 | NO3- | CO32- | Cl- | SO42- |
c/mol·L-1 |
(4)判断K+是否存在,若存在求其最小浓度,若不存在说明理由:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NO和O2转化为NO2的反应机理如下:
①2NO(g) ![]() N2O2(g) (快) △H1<0 平衡常数K1
N2O2(g) (快) △H1<0 平衡常数K1
②N2O2(g)+O2(g) ![]() 2NO2(g) (慢) △H2<0 平衡常数K2
2NO2(g) (慢) △H2<0 平衡常数K2
下列说法正确的是
A.2NO(g)+O2(g) ![]() 2NO2(g) △H=-(△H1-△H2)
2NO2(g) △H=-(△H1-△H2)
B.2NO(g)+O2(g) ![]() 2NO2(g)的平衡常数
2NO2(g)的平衡常数![]()
C.反应过程中的能量变化可用如图表示
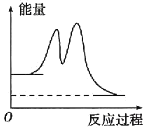
D.反应②的速率大小决定2NO(g)+O2(g) ![]() 2NO2(g)的反应速率
2NO2(g)的反应速率
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应:A(g)+3B(s)![]() 2C(g)+2D(g),在不同条件下的反应速率如下,其中表示的反应速率最大的是( )
2C(g)+2D(g),在不同条件下的反应速率如下,其中表示的反应速率最大的是( )
A.v(A)=0.5mol·L-1·min-1B.v(B)=1.2mol·L-1·s-1
C.v(D)=0.4mol·L-1·min-1D.v(C)=0.1mol·L-1·s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下将2mol SO2和1mol 18O2 充入恒容密闭容器中发生反应:2SO2(g)+18O2 (g) ![]() 2SO3(g) ,达到化学平衡后,下列说法不正确的是
2SO3(g) ,达到化学平衡后,下列说法不正确的是
A.18O 存在于SO2、O2 和SO3 中B.容器中所含氧原子总数为6 NA
C.反应中转移电子的数目为4 NAD.平衡后再充入一定量Ar,重新平衡后,SO3浓度保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究团队在优化催化剂的基础上,通过调节电极的孔道和疏水性增加CO的扩散速率,实现了高选择性将CO电解还原制备乙烯,如图所示。下列叙述错误的是( )
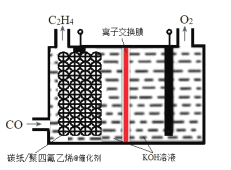
A.碳纸/聚四氟乙烯电极为阴极
B.聚四氟乙烯的作用是吸附并增加CO的浓度
C.为了维持电解的效率,离子交换膜应为阳离子交换膜
D.碳纸上生成C2H4的电极反应式为:2CO+6H2O+8e-=C2H4+8OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】某班几个兴趣小组做了以下实验。
甲组:两同学利用下列试剂:铁粉、0.1mol/L FeCl3溶液、0.1mol/L FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+ 的性质,设计实验方案进行实验,完成下列表格。
探究内容 | 实验方案 | 实验现象 | 写出离子方程式 |
①探究Fe2+具有还原性 | 取少FeCl2溶液,加入少量KSCN溶液后,再往溶液中加入少量________。 | 溶液先不变红,后变为血红色。 | Fe2+发生的反应: _____________ |
②探究Fe3+具有氧化性 | 取少量FeCl3溶液,加入足 量______后,振荡,静置,再往溶液中加入少量KSCN溶液。 | 溶液不变为血红色。 | Fe3+发生的反应:________ |
乙组:两同学利用下图所示的装置进行铁与水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
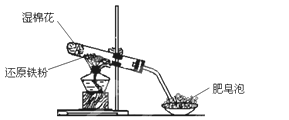
请回答下列问题。
(1)硬质试管中发生反应的化学方程式为_______________。
(2)欲确定反应后硬质试管中固体物质的成分,实验过程如下:
①待硬质试管冷却后,取少许其中的固体物质溶于足量稀硫酸得溶液B;
②取少量溶液B于试管a中,滴加KSCN溶液,溶液没有变红色,则溶液B中的阳离子有_________________,硬质试管中固体物质的成分是_________________。
(3)另取少量溶液B,使其与NaOH溶液反应(按图所示),在胶头滴管挤出NaOH溶液的瞬间可观察到生成白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色。请写出与上述现象中白色沉淀转化红褐色沉淀的化学方程式________________。
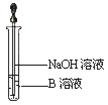
(4)一段时间后,发现a中未变红的溶液变成红色,原因是 _______________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1,则氢气的燃烧热为241.8kJ·mol-1
B.反应SO2(g)+2H2S(g)![]() 3S(s)+2H2O(l)在常温下能自发进行,则该反应的ΔH<0
3S(s)+2H2O(l)在常温下能自发进行,则该反应的ΔH<0
C.已知2C(s)+2O2(g)=2CO2(g) ΔH=a、 2C(s)+O2(g)=2CO(g) ΔH=b,则a>b
D.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O),流程如下:
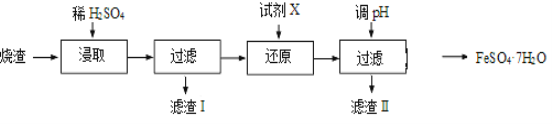
(1)浸取时,溶液中的Fe2+易被空气中的O2氧化,其离子方程式为__________________。能提高烧渣浸取速率的措施有__________________(填字母)。
A.将烧渣粉碎 B.降低硫酸的浓度 C.适当升高温度
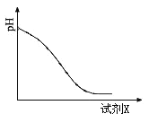
(2)还原时,试剂X的用量与溶液pH的变化如图所示,则试剂X可能是________(填字母)。还原结束时,溶液中的主要阴离子有_____________。
A.Fe粉 B.SO2 C.NaI
(3)滤渣Ⅱ主要成分的化学式为__________________;由分离出滤渣Ⅱ后的溶液得到产品,进行的操作是_______________________________ 、过滤、洗涤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com