
科目: 来源: 题型:
【题目】重排反应是指某种化合物在试剂、温度或其他因素的影响下,发生分子中某些基团的转移或分子内碳原子骨架改变的反应。氢化偶氮苯(a)在一定条件下可重排为联苯胺(b),其变化如图所示。下列有关说法不正确的是

A.b分子中所有碳原子可能共平面B.a和b分子的一氯取代物数目相同
C.a和b均能发生氧化反应D.1mol a或b均能与6molH2完全加成
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.标准状况下,2.24LCCl4中含有分子数目为0.1NA
B.0. 1molFe粉与稀HNO3反应,转移电子数目为0.3NA
C.9.2gNO2和N2O4的混合气体中含有原子数目为0.6NA
D.pH = 13的Ba(OH)2溶液中含有OH-数目为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】钼酸钠晶体(Na2MoO42H2O)是一种金属腐蚀抑制剂。如图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图。
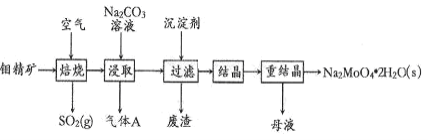
(1) Na2MoO42H2O中钼元素的化合价是_____;在焙烧炉中,空气从炉底进入,矿石经粉碎后从炉顶进入,这样处理的目的是_____
(2)“焙烧”时MoS2转化为MoO3,写出该反应的化学方程式:_____,反应中氧化产物是_____(填化学式)。
(3)“浸取”时含钼化合物发生反应的离子方程式为___________;“结晶”前需向滤液中加入Ba(OH)2固体以除去CO32-。若滤液中c(MoO42-)= 0.40 mol L-1,c(CO32-)= 0.10 molL-1,当BaMoO4开始沉淀时,CO32-的去除率是_____% [已知:Ksp(BaCO3)=1×10-9,Ksp(BaMoO4)=4.0×l0-8]。
(4)“分析纯”的钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与流程中所产生的气体一起通入水中,得到正盐的化学式为_____。
(5)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示:

①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为_____
②碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】1,2—二溴乙烷[BrCH2CH2Br,常温下为无色液体,难溶于水,密度比水大,熔点9℃,沸点132℃]常用作熏蒸消毒的溶剂。利用以下原理可在实验室制取:2C2H5OH![]() CH2=CH2
CH2=CH2![]() BrCH2CH2Br。
BrCH2CH2Br。
已知:140℃时发生副反应生成乙醚(C2H5OC2H5),局部过热会生成SO2、CO2。
实验步骤如下:
①按如图组装仪器(夹持装置略),检查气密性后添加试剂。
②在冰水浴冷却、搅拌下,将20mL浓硫酸缓慢加到10mL95%乙醇中,取出5mL混合液加入三颈烧瓶中,将剩余部分移入恒压滴液漏斗。
③加热A至175℃,打开恒压滴液漏斗活塞,慢慢滴加混合液至D中液溴反应完全。
④将D中产物移到分液漏斗,依次用水、NaOH溶液、水洗涤并分液,往有机相加入适量MgSO4固体,过滤、操作Y,收集到BrCH2CH2Br4.23g。
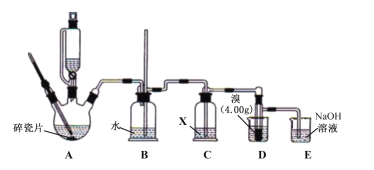
请回答以下问题:
(1)B中长导管的作用是___。
(2)试剂X可选用___(填序号)。
a.NaOH溶液 b.饱和NaHSO3溶液 c.酸性高锰酸钾溶液 d.浓硫酸
(3)D中具支试管还需加入少量水,目的是___。反应过程中需用冷水冷却具支试管,若将冷水换成冰水,可增强冷却效果,但主要缺点是___。
(4)步骤②配制混合液使用的玻璃仪器除了量筒,还有___。
(5)与直接将全部混合液加热到170℃相比,步骤③中往175℃少量混合液中慢慢滴加混合液,最主要的优点是___。
(6)反应结束后,E中溶液检测到BrO3-,则E中发生反应的离子方程式为___。
(7)步骤④操作Y为___。
(8)BrCH2CH2Br的产率为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气净化器中发生的反应为2NO(g)+2CO(g)![]() N2(g)+2 CO2(g)。一定温度下, 在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
N2(g)+2 CO2(g)。一定温度下, 在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
容器 | 温度/(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||||
NO | CO | N2 | CO2 | N2 | CO2 | ||
I | 400 | 0.2 | 0.2 | 0 | 0 | 0.12 | |
II | 400 | 0.4 | 0.4 | 0 | 0 | ||
III | 300 | 0 | 0 | 0.1 | 0.2 | 0.075 | |
下列说法正确是
A. 该反应的ΔS<0、ΔH<0
B. 容器I中达到平衡所需时间2s,则v(N2)=0.06 molL-1·S-1
C. 达到平衡时,体系中c(CO)关系:c(CO,容器II)>2c(CO,容器I)
D. 若起始时向I中充入NO、CO、N2、CO2各0.1mol,开始时V正>V逆
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,H2(g)+CO2(g) ![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() ,该温度下在甲、乙、丙、丁四个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
,该温度下在甲、乙、丙、丁四个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
起始浓度 | 甲 | 乙 | 丙 | 丁 |
c(H2)/mol·L-1 | 0.010 | 0.020 | 0.01 | 0.020 |
c(CO2)/mol·L-1 | 0.010 | 0.010 | 0.02 | 0.020 |
下列判断不正确的是
A.平衡时,丙中CO2的转化率小于60%
B.平衡时,甲中和丁中H2的转化率均是60%
C.平衡时,乙中H2和丙中CO2的物质的量浓度相同,均为0.014 mol·L-1
D.平衡时,乙中和丙中CO的体积分数相同
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中进行反应:A(g)+3B(g)![]() 2C(g),有关下列图像说法的不正确的是( )
2C(g),有关下列图像说法的不正确的是( )
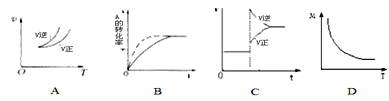
A. 依据图A可判断正反应为放热反应
B. 在图B中,虚线可表示使用了催化剂
C. 若正反应的△H<0,图C可表示升高温度使平衡向逆反应方向移动
D. 由图D中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的△H>0
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组利用酰卤的醇解制备酯的合成路线如图:
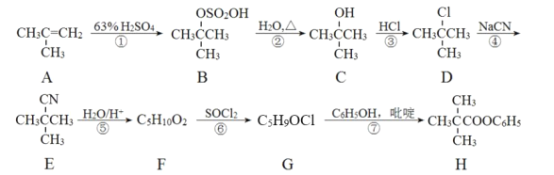
回答下列问题:
(1)A的名称为__(系统命名法),①、⑥的反应类型分别是__、__。
(2)写出②的反应方程式__。
(3)D中官能团的名称是__。
(4)G的结构简式为__。
(5)化合物W与H互为同系物,分子式为C10H12O2,满足以下条件,化合物W的同分异构体有__种,写出其中核磁共振氢谱为5组峰的物质的结构简式___。
a.苯环上有两个取代基 b.遇FeCl3溶液显紫色 c.可以发生银镜反应
(6)写出以甲苯和A为起始原料(其他试剂任选),制备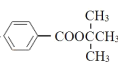 的合成路线:___。
的合成路线:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】硼及其化合物广泛应用于能源、材料等领域。
(1)钕铁硼是磁性材料,被称为“磁王”。钕的价电子排布式为4f46s2,则钕原子的未成对电子数有__个。
(2)氟化硼(BF3)是石油化工的重要催化剂。BF3BF3是__分子(填“极性”或“非极性”),BF3中B—F比BF4-中B—F的键长短,原因是__。
(3)乙硼烷(B2H6)是用作火箭和导弹的高能燃料,氨硼烷(H3NBH3)是最具潜力的储氢材料之一。
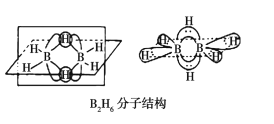
①B2H6的分子结构如图所示,其中B原子的杂化方式为__。
②H3NBH3的相对分子质量与B2H6相差不大,但是H3NBH3的沸点却比B2H6高得多,原因是__。
③同一周期中,第一电离能介于B、N之间的元素有__种。
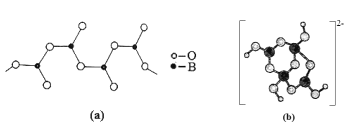
(4)硼酸盐是重要的防火材料。图(a)是一种无限链式结构的硼酸根,则该硼酸根离子符号是__,图(b)是硼酸钠晶体中阴离子(含B、O、H三种元素)的结构,该晶体中含有的化学键有__。
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键
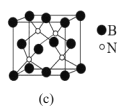
(5)立方氮化硼(BN)是超硬、耐磨、耐高温的新型材料。其晶体结构与金刚石相似,如图c所示,则B的配位数为__,测得B与N的原子核间距为anm,晶体的密度为dg·cm-3,则阿伏加德罗常数NA=__(列计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】H2O2作为绿色氧化剂被应用于废水处理、造纸和化学合成等行业。
(1)已知:H2(g)+![]() O2(g)=H2O(l) ΔH1=-285.8kJ·mol-1
O2(g)=H2O(l) ΔH1=-285.8kJ·mol-1
H2(g)+O2(g)=H2O2(l) ΔH2=-135.8kJ·mol-1
①H2(g)与O2(g)的反应中,在热力学上更有利的产物是__,原因是__。
②常温下,H2O2分解的热化学方程式为__。
(2)我国科学家使用Ag9团簇作催化剂,研究H2O2的合成。各步骤的活化能和反应热,如表所示,利用计算机模拟反应历程如图所示(TS表示过渡态,表示被催化剂吸附的物种)。
Ag9团簇上生成H2O2的活化能Ea和反应热![]()
步骤 | 过渡态 | Ea/kJ |
| |
A | Ag9 | TS1 | 74.1 | +68.7 |
B | H—Ag9 | TS2 | 108.7 | -27.2 |
C | H—Ag9—H+ O2 | TS3 | 78.4 | -75.4 |
D | HOO | TS4 | 124.7 | +31.3 |

①通过降低步骤___(填字母)的能垒(活化能),可以较大幅度提高合成反应的速率。
②反应历程中2到3断裂的化学键为___(填序号)。
A.O2中的氧氧键 B.H2中的氢氢键 C.Ag9OOH中的氧氢键
(3)利用阴阳极同步放电产生H2O2和过硫酸铵[(NH4)2S2O8]的原理如图所示。阳极上放电的离子是___,阴极的电极反应式为___。

(4)常温下,H2O2分解速率方程v=0.0625·c(H2O2)mg·L-1·s-1,c(H2O2)随时间变化如下表:
C(H2O2) (mg | 10000.0 | 8000.0 | 4000.0 | 2000.0 | 1000.0 |
分解时间(s) | 0 | 7 | 23 | 39 | 55 |
①当c(H2O2)=8000.0mg·L-1时,v=__mg·L-1·s-1;
②当c(H2O2)降为5000.0mg·L-1时,分解时间为___s。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com