
科目: 来源: 题型:
【题目】T℃时,在2L的密闭容器中,气体X、Y、Z的物质的量随时间的变化曲线如图所示。
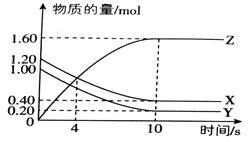
(1)该反应的化学方程式为_________________________.
(2)0~10s内,X的化学反应速率为___________________.
(3)该反应在不同温度下的平衡常数如表所示:
T/℃ | 100 | 220 | 830 | 1000 | 1200 |
K | 45.00 | 32.00 | 1.00 | 0.60 | 0.38 |
则该反应的ΔH__________0 (填“>”、“<”或“=”)
(4)830℃时,在容积为10L的恒容密闭容器中充入5molX气体、7.8molY气体和7.1mol Z气体,此时υ(正)_______υ(逆) (填“>”、“<”或“=”)
(5)上图所示反应的温度为_________________。
查看答案和解析>>
科目: 来源: 题型:
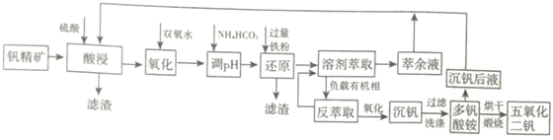
【题目】钒、钛、铝组成的金属合金![]() 常用于飞机发动机、宇航船舱骨架、导弹、军舰的水翼等。钒精矿可表示为
常用于飞机发动机、宇航船舱骨架、导弹、军舰的水翼等。钒精矿可表示为![]() ,还含有其他难溶硫酸盐杂质。“萃取”钒工艺流程路线图如下:
,还含有其他难溶硫酸盐杂质。“萃取”钒工艺流程路线图如下:
已知:①![]() 中
中![]() 为
为![]() 价。
价。
②“氧化”后的溶液中钒以![]() 存在,反萃取后的溶液中钒以
存在,反萃取后的溶液中钒以![]() 存在。
存在。
③![]() 为萃取剂。
为萃取剂。
回答下列问题:
(1)将钒精矿![]() 写成氧化物的形式____________________________。
写成氧化物的形式____________________________。
(2)写出“氧化”过程中反应的离子方程式____________________________。
(3)加入![]() 调节溶液
调节溶液![]() 的目的是____________________________。
的目的是____________________________。
(4)“还原”过程中主要反应的离子反应方程式为____________________________。
(5)为了提高![]() 的产率,反萃取剂应该呈_________(填“酸性”“碱性”或“中性”)。
的产率,反萃取剂应该呈_________(填“酸性”“碱性”或“中性”)。
(6)若用氧化剂![]() “氧化沉钒”时,生成
“氧化沉钒”时,生成![]() ,至少需要
,至少需要![]() _________
_________![]() 。
。
(7)写出煅烧多钒酸铵![]() 的化学反应方程式__________________。
的化学反应方程式__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】水合肼(N2H4H2O)是制备叠氮化钠(NaN3)的原料,而叠氮化钠又是汽车安全气囊最理想的气体发生剂的原料。如图是工业水合肼法制备叠氮化钠的工艺流程。

查阅资料:①水合肼有毒且不稳定,具有强还原性和强碱性;
②有关物质的物理性质如下表:
物质 | 甲醇 | 水合肼 | 亚硝酸甲酯 | 叠氮化钠 |
熔点(℃) | -97 | -40 | -17 | 275(410℃:易分解) |
沸点(℃) | 64.7 | 118.5 | -12 | — |
回答下列问题:
Ⅰ.合成水合肼。实验室水合肼合成水合肼装置如图所示,NaClO碱性溶液与尿素CO(NH2)2水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
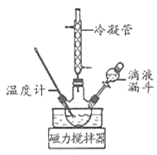
(1)实验中通过滴液漏斗向三颈瓶中缓慢滴加NaClO溶液的原因是_____;N2H4 的结构式为_____,制取N2H4H2O的离子方程式为_________。
II.制备叠氮化钠。实验室可利用如图所示的装置及药品制备叠氮化钠。
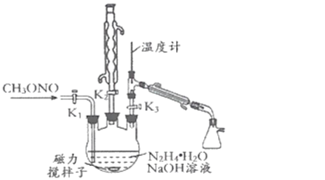
(2)①根据实验发现温度在20℃左右反应的转化率最高,但是该反应属于放热反应,因此 可釆取的措施是_____;流程中A溶液蒸馏前,图中装置中开关K1、K2、K3的合理 操作顺序是______。
②写出该方法制备叠氮化钠的化学方程式:_____。
(3)流程中由B溶液获得叠氮化钠产品的实验步骤为_____,减压过滤,晶体用乙醇洗涤23次后,再_____干燥。
(4)化工生产中,多余的叠氮化钠常使用次氯酸钠溶液处理,在酸性条件下,二者反应可生成无毒的气体。若处理6.5gNaN3,理论上需加入0.5mol L-1的NaClO溶液_____mL
查看答案和解析>>
科目: 来源: 题型:
【题目】煤和甲烷既是重要的常用燃料,又是重要的化工原料。根据题意,回答下列问题:
I.煤制天然气过程中,存在多种化学反应,其中在煤气化装置中发生反应①:C(s) + H2O(g)=CO(g) + H2(g) H = +135 kJ mol-1 ,而在水气变换装置中发生反应②:CO(g)+H2O(g)=CO2(g)+ H2(g) H =-41 kJ mol-1
(1)煤气化前,需要通入一定量的氧气与碳发生燃烧反应,请利用平衡移动原理说明通入氧气的作用:_____________________
(2)写岀碳和二氧化碳反应生成一氧化碳的热化学方程式_____。
(3)如图表示发生反应①后进入反应②装置的n( H2O)/n(CO)与反应②中CO平衡转化率、温度的变化关系。

若n(H2O)/n(CO)为0.8,一定量的煤和水蒸气经反应①和反应②后,得到CO与H2的 物质的量之比为1:3,则反应②所对应的温度是_____(填“T1”、“T2”或“T3”)。
Ⅱ.甲烷重整技术主要是利用甲烷和其他原料来制备合成气(CO和h2混合气体)。现在常(见的重整技术有甲烷——二氧化碳重整、甲烷——水蒸气重整,其反应分别为CH4(g)+3CO2(g)2H2O(g)+4CO(g);CH4(g)+H2O(g)CO(g)+3H2(g)
(4)甲烷——二氧化碳重整的催化转化原理如图所示:
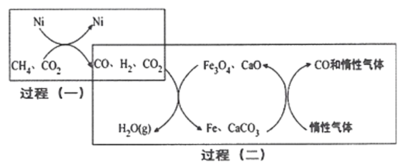
①过程(二)实现了含氢物种与含碳物种的分离,写出生成H2O(g)的化学方程式:______
②假设过程(一)和过程(二)中各步反应均转化完全,则下列说法正确的是_____ (填序号)。
a.过程(一)和过程(二)中均含有氧化还原反应
b.过程(二)中使用的催化剂为Fe3O4和CaCO3
C.若过程(一)投料比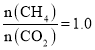 ,可导致过程(二)中催化剂失效
,可导致过程(二)中催化剂失效
(5)通过计算机模拟甲烷——水蒸气重整实验测得,在操作压强为0.1Mpa、水碳比n(H2O)/n(CH4)为1.0,温度为900℃,反应达到平衡时,H2的物质的量分数为0.6。已知该反应的速率方程v=kP(CH4)·P-1(H2),式中k为速率常数,P为气体分压,气体分压=总压×气体物质的量分数,则此时该反应速率v=_____(用含k的式子表示);900℃时,该反应的压强平衡常数Kp=_____(用平衡分压代替平衡浓度计算)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有一种新型药物,具有血管扩张活性的选择性[M肾上腺素受体拮抗剂],用于合成该药物的中间体H的部分流程如下:
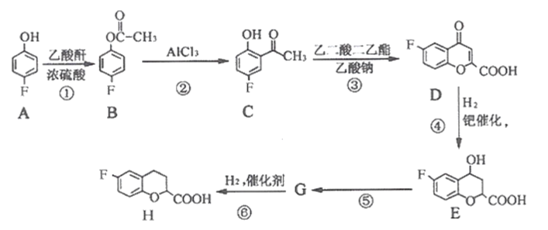
已知:乙酸酐的结构简式为:![]() 。回答下列问题:
。回答下列问题:
(1)A的名称是_____;C中的含氧官能团的结构简式为_____
(2)反应①、④的反应类型分别为_____、_____
(3)D的分子式为_____;E—G的化学方程式为_____
(4)满足下列条件的B的同分异构体共有_____种(不考虑立体异构)。
Ⅰ.分子中含有苯环
Ⅱ.分子中含有5种不同化学环境的氢
Ⅲ.能与NaHCO3反应生成CO2
(5)根据已有知识并结合相关信息,写出以![]() 和乙酸酐为原料制备一种结构简式为
和乙酸酐为原料制备一种结构简式为 的合成路线流程图_____(无机试剂任选)。
的合成路线流程图_____(无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50mL 0.50molL-1盐酸倒入小烧杯中,测出盐酸的温度,然后把温度计上的 酸用水冲洗干净;
②用另一量筒量取50mL 0.55molL-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
(1)实验中NaOH溶液稍稍过量的目的是_________________________________________。
(2)使盐酸与NaOH溶液混合均匀的正确操作是_______(填序号).
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动
(3)实验中改用60mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1 NaOH溶液进行反应,与上述实验相比,放出的热量______________(填“ 偏多”“偏少”或“相等”,下同),所求得的中和热ΔH ______________。
(4)如果上述实验测得中和热ΔH = -55.6kJ/mol,并已知:Ba2+(aq)+2OH-(aq)+ 2H++SO42- (aq)=BaSO4(s) +2H2O(l) ,ΔH=-1584.2 kJ·mol-1。则生成BaSO4(s)的反应热ΔH=______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置______。![]() 的中子数为________。
的中子数为________。
已知:P(s,白磷)=P(s,黑磷) ΔH=-39.3 kJ·mol-1;P(s,白磷)=P(s,红磷) ΔH=-17.6 kJ·mol-1;由此推知,其中最稳定的磷单质是________。
(2)氮和磷氢化物性质的比较:热稳定性:NH3________PH3(填“>”或“<”)。沸点:N2H4________P2H4(填“>”或“<”),判断依据是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。

(1)试剂X的化学式________。A中制取Cl2的离子方程式____________________。
(2)试剂Y的名称为______________。
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和____________________________;
假设2:存在三种成分:NaHCO3和__________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中 | |
步骤2:向A试管中滴加BaCl2溶液 | __________________ |
步骤3:______________ | __________________ |
(4)已知Cl2O与水反应生成次氯酸,则D中Cl2O进入E反应的化学方程式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向20 mL某浓度的AlCl3溶液中滴加2 mol·L-1的NaOH溶液时,得到Al(OH)3沉淀的质量(g)与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:

(1)图中A点表示的沉淀是__________(写化学式),其物质的量为____________。
(2)反应至A点时消耗NaOH溶液的体积为______________。
(3)图中B点溶液中的溶质有________________。
(4)AlCl3溶液的浓度为______________。
(5)O点到B点反应的总离子方程式可表示为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,下列说法正确的是
A. X、Y、Z、W的原子半径依次减小
B. W与X形成的化合物中只含离子键
C. W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D. 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com