
科目: 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84g·cm-3)配制250mL0.4mol·L-1稀硫酸,有以下实验仪器供选:
A.10mL量筒 B.托盘天平 C.玻璃棒 D.250mL容量瓶 E.500mL容量瓶 F.胶头滴管 G.烧杯
(1)需量取浓硫酸的体积为___mL。
(2)实验时不可选用的仪器有(填序号)___。
(3)配制过程中,下列情况会使配制结果偏高的是___(填序号)
①容量瓶使用时未干燥;
②定容时俯视刻度线观察液面;
③将浓硫酸在烧杯中稀释后未经冷却就转移至容量瓶中,并定容;
④定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线。
(4)配制过程中,实验操作步骤为:___
A.在烧杯中注入蒸馏水(溶液体积少于250mL),沿烧杯壁注入量取的浓硫酸用玻璃棒搅拌,使其混匀。
B.待稀释的硫酸冷却后,沿玻璃棒注入250mL的容量瓶中
C.用量筒量取密度为1.84g/cm3质量分数为98%的浓硫酸
D.用蒸馏水洗涤烧杯2~3次,将洗涤液注入容量瓶中。
E.往容量瓶中小心加蒸馏水至液面接近刻度1-2cm处,改用__加蒸馏水,使溶液凹液面恰好与刻度线相切。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的铁粉在氯气中充分燃烧后,将所得固体完全溶于稀盐酸,制得溶液A。
(1)铁在氯气中燃烧的化学方程式是____________________________。
(2)推测A中可能含有的金属阳离子:①Fe3+;②只有Fe2+;③______。
甲同学为探究溶液的组成,实验如下:
实验步骤 | 实验现象 | 实验结论及反应离子方程式 |
取少量溶液A于试管中,加入KSCN溶液。 | ________ | 假设②不成立,假设①或③成立;反应的离子方程式是_____________ 。 |
(3)乙同学继续探究溶液A的组成。
查阅资料:16HCl+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O
实验过程:另取少量溶液A于试管中,逐滴加入酸性KMnO4溶液,充分振荡,KMnO4紫色褪去。
实验结论:__________(填写字母序号)。
a.可能有Fe2+ b.可能无Fe2+ c.一定有Fe2+
(4)结论:A中含有的阳离子是_________,简述理由:________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列化学反应,按要求回答问题:
A.(NH4)2SO3![]() 2NH3↑+H2O+SO2↑ B.2CO+O2
2NH3↑+H2O+SO2↑ B.2CO+O2![]() 2CO2
2CO2
C.2C+SiO2![]() Si+2CO↑ D.NH4NO3
Si+2CO↑ D.NH4NO3![]() N2O+ 2H2O
N2O+ 2H2O
E.CaCO3 + CO2+ H2O=Ca(HCO3)2 F.MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(1)以上反应中,属于氧化还原反应的是________________(填上述反应的编号);
(2)在反应MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O中:
MnCl2 + Cl2↑+ 2H2O中:
①氧化剂是___________,氧化产物是________。
②在该反应方程式中用双线桥法表示出电子转移的方向和数目_______________。
③若产生了标准状况下3.36L的氯气,则被氧化的HCl的物质的量为________摩尔。
查看答案和解析>>
科目: 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上可利用多种钼矿制备钼酸钠。镍钼矿(主要含有MoS2、NiS2、NiS、FeS2、SiO2和C)是我国特有的一种多金属复杂硫化矿资源,常用来进行钾、镍等战略有色金属的提取。工业上进行选择性还原熔炼可以提取镍铁合金同时得到钼酸钠晶体(Na2MoO4·2H2O),其主要流程如图:
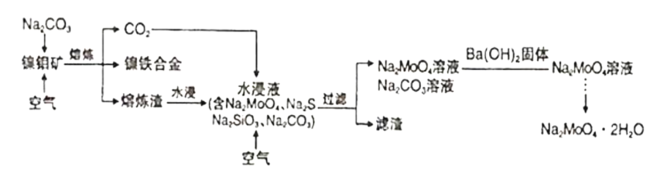
已知:Na2MoO4·2H2O是白色晶体,在水中的溶解度随温度升高而增大。
(1)还原熔炼过程中发生了较多的化学变化请结合题干信息补充完整NiS发生的化学反应方程式,并配平。___
□NiS+□Na2CO3+3C+2O2![]() ___+____+___。
___+____+___。
(2)向水浸液中通人适量CO2和空气,然后过滤,所得滤渣的主要成分为___。
(3)已知过滤所得混合液中c(MoO42-)=0.40mol·L-1,c(CO32-)=0.10mol·L-1,加入Ba(OH)2固体除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是___。
(已知Ksp(BaCO3)=1×10-9,Ksp(BaMoO4)=4×10-8)
(4)从钼酸钠溶液中获取钼酸钠晶体的操作___。
(5)工业上还可以利用如图所示电解装置浸取辉钼矿(主要成分为MoS2)得到Na2MoO4和Na2SO4溶液,制备钼酸钠晶体。
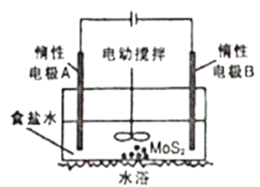
①电解一段时间,电极B附近pH___(填“增大”“减小”或“不变”);
②简述MoO42-生成的原因___。
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在二种不同介质中的腐蚀速率实验结果如图所示:
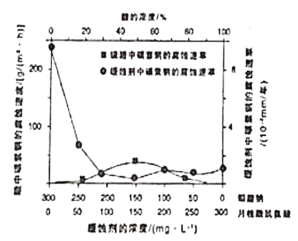
①已知:钼酸钠、月挂酰肌氨酸的相对分子质量分别为M1、M2,要使碳素钢的缓蚀效果最优,钼酸钠和月挂酰肌氨酸的物质的量浓度比应为____;
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】对硝基苯甲酸(![]() )是一种广泛用于医药、染料、感光材料等的重要精细化工中间体。工业上以对硝基甲苯(
)是一种广泛用于医药、染料、感光材料等的重要精细化工中间体。工业上以对硝基甲苯(![]() )、Cr(SO)3等物质为主要原料,通过间接电合成法制备对硝基苯甲酸,生产工艺流程如下:
)、Cr(SO)3等物质为主要原料,通过间接电合成法制备对硝基苯甲酸,生产工艺流程如下:
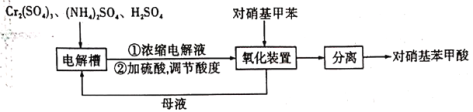
已知:①对硝基甲苯:黄色晶体,熔点为51.7℃,沸点为238.5℃,不溶于水,易溶于乙醇、乙醚、氯仿和苯。②对硝基苯甲酸:黄色晶体,熔点为242℃,沸点为359℃,微溶于水,溶于乙醇,能升华。
回答下列问题:
(1)电解制备Cr2O72-:用H型隔膜电解槽电解制备Cr2O72-,装置如下图1所示。外接电源的负极为__(填“A”或“B”),反应II的离子方程式为_______。
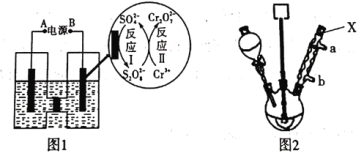
(2)氧化制备对硝基苯甲酸:用上图2所示装置制备对硝基苯甲酸,具体过程如下:
步骤1:向250 mL三颈烧瓶中依次加入一定量含Cr2O72-的电解液、对硝基甲苯,搅拌、水浴升温到设定温度,恒温下进行反应,直至反应液由棕红色变为墨绿色时为止。
步骤2:待反应混合物冷却至室温后,与适量冰水充分混合,抽滤。滤液返回电解槽中重新电解。
步骤3:把步骤2中抽滤所得固体溶于5%的热NaOH溶液中(约60℃),待温度降到50℃时,抽滤,向滤液中加入过量2 mol/L H2SO4,析出黄色沉淀,再抽滤,并用冷水洗涤,然后在低于80℃的条件下烘干,可得粗产品。
①仪器X的名称是_____,冷却水应从___口进入(填“a”或“b”)。
②步骤2中,抽滤所得固体的主要成分是_____。
③步骤3中,用NaOH溶液处理后,需待温度降到50℃时进行抽滤的原因是______。
④制得的粗产品需要进一步纯化,根据对硝基苯甲酸的有关性质可知,对其进行纯化还可以采用_____法完成。
⑤该合成技术的优点是实现了____(填化学式)的循环利用,绿色环保。
(3)测定对硝基苯甲酸的纯度:称取1.670 g粗产品,配成100 mL溶液,取25.00 mL溶液,用0.1000 mol·L-1 KOH溶液滴定,重复滴定四次,每次消耗KOH溶液的体积如下表所示。已知:对硝基苯甲酸的摩尔质量为167.0 g·mol-1,则对硝基苯甲酸的纯度为_____。
第一次 | 第二次 | 第三次 | 第四次 | |
体积( mL) | 23.00 | 23.10 | 21.40 | 22.90 |
查看答案和解析>>
科目: 来源: 题型:
【题目】稠环芳香烃是指两个或两个以上的苯环通过共用环边所构成的多环有机化合物。常见的稠环芳香烃如萘、蒽、菲、芘等,其结构分别为
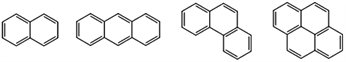
萘 蒽 菲 芘
下列说法不正确的是
A. 萘的分子式为C10H8,与H2完全加成后,产物的分子式为C10H18
B. 蒽、菲、芘的一氯代物分别有3种、5种、5种
C. 上述四种物质的分子中,所有碳原子均共平面
D. 上述四种物质均可与浓硝酸发生硝化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E 元素的周期序数与主族序数相等。
(1)E 元素在周期表中的位置___________。
(2)写出A2W2的电子式为____________。
(3)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式________。
(4)元素D的单质在一定条件下,能与 A 单质化合生成一种化合物DA,熔点为800℃,DA能与水反应放氢气,若将1molDA和1molE 单质混合加入足量的水,充分反应后成气体的体积是_________(标准状况下)。
(5)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列物质:①氯气、②铜片、③碳酸钙、④蔗糖、⑤HCl气体、⑥SO2气体、⑦氨水,能导电的是________________,属于电解质的是_________________。(填编号)
(2)节日焰火利用的是____反应,城市射灯在夜空形成五颜六色的光柱,属于___效应。
(3)①除去铁粉中混用铝粉,选用的试剂为:___________;
②NaHCO3溶液中混有Na2CO3选用的试剂为_____________;
③除去Na2CO3粉末中的NaHCO3,采用的方法__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是________,D是________,G是________,H是________(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:_____________________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为__________________________。
(3)A中元素的原子结构示意图为________________。
(4)上述反应中属于氧化还原反应的是_________(填写序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶体积的关系如图所示,由此确定,原溶液中含有的阳离子是:( )

A.Mg2+、Al3+、Fe2+B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+D.只有Mg2+、Al3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com