
科目: 来源: 题型:
【题目】下列反应中,不是氧化还原反应的是 ( )
①H2+Cl2![]() 2HCl
2HCl
②Na2CO3+2HCl=2NaCl+H2O+CO2↑
③2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
④CuO+2HNO3=Cu(NO3)2+H2O
⑤2HgO![]() 2Hg+O2↑
2Hg+O2↑
A.②④B.①③C.①②③D.④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用以下装置制备并检验Cl2的性质。下列说法正确的是( )
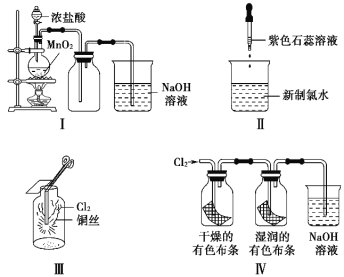
A. Ⅰ图:若MnO2过量,则浓盐酸可全部消耗完
B. Ⅱ图:证明新制氯水只有酸性
C. Ⅲ图:产生了棕黄色的雾
D. Ⅳ图:湿润的有色布条褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。
请回答下列问题。
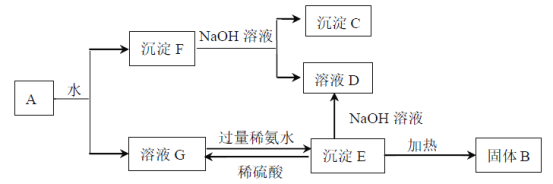
(1)图中涉及分离溶液与沉淀的方法是______________________________。
(2)B、C、D、E4种物质的化学式为:B___________、C___________、D___________、E___________。
(3)沉淀F与NaOH溶液反应的离子方程式为_________________________________。溶液G与过量稀氨水反应的化学方程式为____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在平板电视显示屏生产过程中产生的废玻璃粉末中含有二氧化铈(CeO2)。
(1)在空气中煅烧Ce(OH)CO3可制备CeO2,该反应的化学方程式______________;
(2)已知在一定条件下,电解熔融状态的CeO2可制备![]() ,写出阳极的电极反应式:_______。
,写出阳极的电极反应式:_______。
(3)某课题组以上述废玻璃粉末(含有SiO2,Fe2O3,CeO2以及其它少量不溶于稀酸的物质)为原料,设计如图流程对资源进行回收,得到Ce(OH)4和硫酸铁铵。

①过滤得到滤渣B时,需要将其表面杂质洗涤干净,沉淀洗涤的的操作是_______。
②反应①的离子方程式为____________。
③操作I的名称是_____________。
④已知:M[Ce(OH)4]=208g/mol,氧化还原滴定法测定制得的Ce(OH)4产品纯度的流程为:称取0.600gCe(OH)4样品→加硫酸溶解→用0.1000mol/LFeSO4标准液滴定,消耗25.00mL标准液。该产品中Ce(OH)4的质量分数为____________(小数点后保留两位),若滴定所用FeSO4溶液己在空气中露置了一段时间,则测得该Ce(OH)4产品的纯度___________(“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种用于隐形眼镜材料的聚合物片段如下:

下列关于该高分子说法正确的是
A. 结构简式为:
B. 氢键对该高分子的性能没有影响
C. 完全水解得到的高分子有机物,含有官能团羧基和碳碳双键
D. 完全水解得到的小分子有机物,具有4种不同化学环境的氢原子
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年11月《Science》杂志报道了王浩天教授团队发明的制取![]() 的绿色方法,原理如图所示(已知:
的绿色方法,原理如图所示(已知:![]() ,
,![]() )。下列说法错误的是( )
)。下列说法错误的是( )
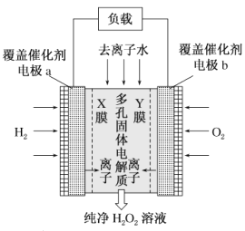
A.X膜为选择性阳离子交换膜
B.催化剂可促进反应中电子的转移
C.每生成![]() 电极上流过
电极上流过![]()
D.b极上的电极反应为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用8.7g的MnO2与50mL足量的浓盐酸制取氯气,其反应方程式为:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)求生成氯气的体积(标准状况)______________
(2)若向反应后的剩余溶液中,加入足量AgNO3溶液,生成沉淀57.4g,求原浓盐酸的物质的量浓度______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某种化合物(如图)由 W、X、Y、Z 四种短周期元素组成,其中 W、Y、Z 分别位于三个不同周期,Y 核外最外层电子数是 W 核外最外层电子数的二倍;W、X、Y 三种简单离子的核外电子排布相同。下列说法不正确的是

A.原子半径:W < X < Y < Z
B.X 与 Y、Y 与 Z 均可形成具有漂白性的化合物
C.简单离子的氧化性: W X
D.W 与 X 的最高价氧化物的水化物可相互反应
查看答案和解析>>
科目: 来源: 题型:
【题目】一种长效、缓释阿司匹林的合成路线如下图所示:
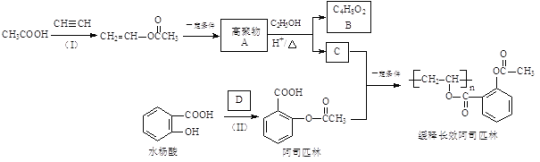
完成下列填空:
已知: RCOOR′+R"OH![]() RCOOR"+R′OH(R、R′、R"代表烃基)
RCOOR"+R′OH(R、R′、R"代表烃基)
(1)结构简式:A______________,B_______________;
(2)反应(Ⅰ)的反应类型为_________________,缓释长效阿司匹林结构中与“缓释作用”有关的官能团的名称为________________。
(3)D为乙酸酐,结构简式为![]() ,写出一种与D互为同分异构体且能发生银镜反应的酯类的结构简式:__________。
,写出一种与D互为同分异构体且能发生银镜反应的酯类的结构简式:__________。
(4)已知水杨酸酸性主要来源于“![]() ”,阿司匹林中将“
”,阿司匹林中将“![]() ”转化为“
”转化为“![]() ”能大大降低对肠胃的刺激,由此你可以得出的结论是_________。
”能大大降低对肠胃的刺激,由此你可以得出的结论是_________。
(5)已知:①乙炔与无机酸的反应和反应(Ⅰ)类似;②![]() ,现以乙炔、甲醇为原料,无机试剂任选,合成丙烯酸甲酯(
,现以乙炔、甲醇为原料,无机试剂任选,合成丙烯酸甲酯(![]() )_________。(合成路线常用的表示方式为:
)_________。(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目: 来源: 题型:
【题目】乙二酸(![]() )俗称草酸,在实验研究和化学工业中应用广泛。完成下列填空:
)俗称草酸,在实验研究和化学工业中应用广泛。完成下列填空:
(1)室温下,测得![]() 溶液的
溶液的![]() ,写出草酸的电离方程式______。
,写出草酸的电离方程式______。
(2)草酸溶液中微粒的物质的量分数随溶液![]() 变化如图所示:
变化如图所示:
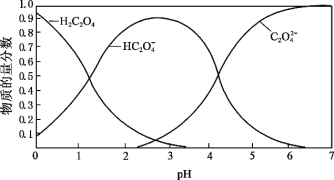
i.向草酸溶液中滴加![]() 溶液至
溶液至![]() 时发生的主要反应的离子方程式是:_______。
时发生的主要反应的离子方程式是:_______。
ii.继续加入![]() ,调节
,调节![]() 由2.5直至大于6.5,调节过程中
由2.5直至大于6.5,调节过程中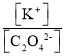 比值将________(选填“增大”、“减小”或“不变”)。
比值将________(选填“增大”、“减小”或“不变”)。
(3)工业上制取草酸的原理为:![]()
该反应的平衡常数表达式![]() _______,下列能说明反应已经达到平衡的是______。
_______,下列能说明反应已经达到平衡的是______。
a 平衡常数K保持不变 b 反应液的pH保持不变
c 丁醇的浓度保持不变 d 反应液的总质量保持不变
(4)草酸可用于测定高锰酸钾的质量分数,原理如下:![]()
i.一定条件下,测得上述反应中溶液中![]() 的浓度随反应时间的变化如图,以
的浓度随反应时间的变化如图,以![]() 浓度的变化表示此反应
浓度的变化表示此反应![]() 内的平均反应速率为____________
内的平均反应速率为____________![]()
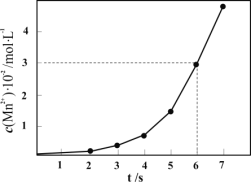
ii.分析![]() 的浓度随反应时间的变化的可能原因(反应过程中温度没有明显变化)_____。
的浓度随反应时间的变化的可能原因(反应过程中温度没有明显变化)_____。
(5)取![]() 的高锰酸钾产品,配成
的高锰酸钾产品,配成![]() 溶液,取出
溶液,取出![]() ,消耗
,消耗![]() 草酸标准溶液
草酸标准溶液![]() ,则样品中高锰酸钾的质量分数为______。
,则样品中高锰酸钾的质量分数为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com