
科目: 来源: 题型:
【题目】现有X、Y、Z三种元素,已知有如下情况:
①X、Y、Z的单质在常温下均为气体。
②X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色。
③XZ极易溶于水,在水溶液中电离出X+和Z-。XZ的水溶液可使石蕊试液变红。
④两分子X的单质可与一分子Y的单质化合生成两分子X2Y,X2Y常温下为液体。
⑤Z的单质溶于X2Y中,所得溶液具有漂白作用。
请完成下列问题:
(1)请写出Z-的的离子结构示意图_____________。
(2)请写出Z单质溶于X2Y中发生反应的化学方程式_____________。
(3)请写出Z单质与NaOH反应的化学方程式:_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究。查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。
I.摩擦剂中氢氧化铝的定性检验,取适量牙膏样品,加水充足搅拌、过滤。
(1)往滤渣中加入过量![]() 溶液,过滤。氢氧化铝与
溶液,过滤。氢氧化铝与![]() 溶液反应的离子方程式是___________
溶液反应的离子方程式是___________
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸,观察的现象是__________
Ⅱ.牙膏样品中碳酸钙的定量测定。利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的![]() 沉淀质量,以确定碳酸钙的质量分数。
沉淀质量,以确定碳酸钙的质量分数。
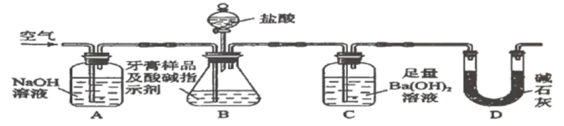
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:_____。
(4)C中反应生成沉淀的离子方程式是_______________。
(5)下列各项措施中,不能提高测定准确度的是________(填标号)。
a.在加入盐酸之前,应排净装置内的![]() 气体
气体
b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取![]() 样品三份,进行三次测定,测得
样品三份,进行三次测定,测得![]() 平均质量为
平均质量为![]() 。则样品中碳酸钙的质量分数为_____________________。
。则样品中碳酸钙的质量分数为_____________________。
(7)有人认为不必测定C中生成的![]() 质量,只要测定装置C在吸收
质量,只要测定装置C在吸收![]() 前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是____________________。
前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、已知下面在298K时的热化学方程式:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,CH4(g)+2O2(g)=CO2(g)+2H2O (l) ΔH=-890.3 kJ·mol-1,C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1。根据上面的热化学方程式完成下列问题:
(1)通过计算说明等质量的H2、C、CH4完全燃烧时放出热量最多的是___。
(2)根据以上反应,则C(s)+2H2(g)=CH4(g)的焓变ΔH=___。
(3)已知H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式:___。
Ⅱ、为了解金属腐蚀的原因和寻求防止金属腐蚀的方法具有重要意义。
(1)分别放在以下装置(都盛有0.1mol·L-1的H2SO4溶液)中的四块相同的纯锌片,其中腐蚀最快的是___。
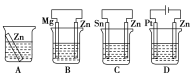
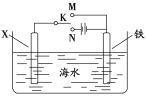
(2)利用如图装置,可以模拟铁的电化学防护。其中X为碳棒,为减缓铁的腐蚀,开关K应置于___处。若X为锌,开关K置于M处,该电化学防护法称为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制备并收集干燥、纯净氯气的装置如图所示:
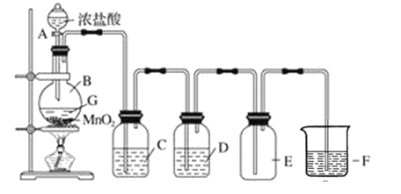
(1)写出实验室制备Cl2的化学方程式:________________________。
(2)写出指定试剂的名称,C_____________________,D_______________________。
(3)C的作用是_______________,D的作用是_______________,F的作用是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组学生用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法正确的是
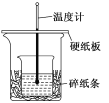
A. 如图条件下实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯间填满碎纸条的作用是固定小烧杯
D. 若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,从理论上说所求中和热不相等
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,反应的化学方程式为______,若将4mol氯气通入足量的石灰乳中,理论上可得到次氯酸钙多少克?________
查看答案和解析>>
科目: 来源: 题型:
【题目】铂钴合金是以铂为基含钴二元合金,在高温下,铂与钻可无限互溶,其固体为面心立方晶格。铂钻合金磁性极强,磁稳定性较高,耐化学腐蚀性很好,主要用于航天航空仪表、电子钟表、磁控管等。氟及其化合物CuF用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________________方法区分晶体、准晶体和非晶体。
(2)基态F原子的价层电子排布图(轨道表达式)为________________。
(3) [H2F]+[SbF6]ˉ (氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为______________,与[H2F]+具有相同空间构型且中心原子与F原子同周期的分子是_____________。
(4)NH4F(氟化铵)可用于玻璃的蚀刻防腐剂、消毒剂。![]() 中心原子的杂化类型是____________;氟化铵中存在_______________(填字母)。
中心原子的杂化类型是____________;氟化铵中存在_______________(填字母)。
A.离子键 B.σ键 C.π键 D.氢键
(5)SF4被广泛用作高压电气设备的绝缘介质。SF4是一种共价化合物,可通过类似于Bom-Haber循环能量构建能量图计算相关键能。则F-F键的键能为_____kJ/mol,S-F键的键能为______ kJ/mol。
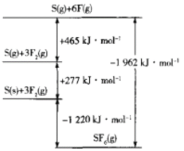
(6)CuCl的熔点为326℃,能升华,熔化呈液态时不导电;CuF的熔点为1008℃,熔化呈液态时能导电。
①CuF中Cu+的基态价电子排布式________铜元素位于元素周期________区,金属Cu的堆积模型为__________________。
②CuF的熔点比CuCl的高,原因是______________
③已知NA为阿伏加德罗常数的值,CuF的密度为7.1g/cm3,晶胞结构如图所示,则CuF的晶胞参数a=_______nm(列出计算式)
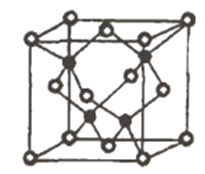
查看答案和解析>>
科目: 来源: 题型:
【题目】用“双线桥”标出电子转移的方向和数目,并分别指出 氧化剂和氧化产物。
(1)Fe+CuSO4=FeSO4+Cu ________ 氧化剂是 ____________氧化产物是_____________,
(2)3CO+Fe2O3![]() 3CO2+2Fe ________ 氧化剂是 ____________氧化产物是_____________,
3CO2+2Fe ________ 氧化剂是 ____________氧化产物是_____________,
查看答案和解析>>
科目: 来源: 题型:
【题目】关于下列四个图像的说法中正确的是
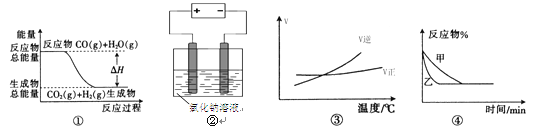
A.图①表示可逆反应“CO(g)+H2O(g)![]() CO2(g)+H2(g)”中的ΔH小于0
CO2(g)+H2(g)”中的ΔH小于0
B.图②是在长时间电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1︰1
C.图③表示可逆反应“A2(g)+3B2(g)![]() 2AB3(g)”的ΔH大于0
2AB3(g)”的ΔH大于0
D.图④表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
查看答案和解析>>
科目: 来源: 题型:
【题目】含氮化合物对环境、生产和人类生命活动等具有很大的影响。请按要求回答下列问题
(1)利用某分子筛作催化剂,NH3可脱除工厂废气中的NO、NO2,反应机理如下图所示。A包含物质为H2O和___________(填化学式)

(2)已知:4NH3(g)+6NO(g) =5N2(g)+6H2O(g) △H1=-a kJ/mol
4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H2=-b kJ/mol
H2O(l)=H2O(g) △H3=+c kJ/mol
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l)的△H=___________ kJ/mol
(3)工业上利用氨气生产氢氰酸(HCN的反应为:CH4(g)+NH3(g)![]() HCN(g)+3H2(g ) △H>0
HCN(g)+3H2(g ) △H>0
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图甲所示。则X可以是___________(填字母序号)

a.温度 b.压强 c.催化剂 d.![]()
②在一定温度下,向2L密闭容器中加入 n mol CH4和2 moI NH3,平衡时NH3体积分数随n变化的关系如图乙所示。

a点时,CH4的转化率为___________%;平衡常数:K(a)_____K(b)(填“>”“=”或“<”)。
(4)肌肉中的肌红蛋白(Mb)与O2结合生成MbO2,其反应原理可表示为: Mb(ag)+O2(g)![]() MbO2(aq),该反应的平衡常数可表示为:
MbO2(aq),该反应的平衡常数可表示为:![]() 。在37℃条件下达到平衡时,测得肌红蛋白的结合度(a)与P(O2)的关系如图丙所示[
。在37℃条件下达到平衡时,测得肌红蛋白的结合度(a)与P(O2)的关系如图丙所示[![]() ]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。
]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。

①试写出平衡常数K与速率常数k正、k逆之间的关系式为K=___________(用含有k正、k逆的式子表示)。
②试求出图丙中c点时,上述反应的平衡常数K=___________kPa-1。已知k逆=60s-1,则速率常数k正=___________s-1·kPa-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com