
科目: 来源: 题型:
【题目】可逆反应:2NO2(g)![]() 2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是
2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是
A.单位时间内生成n molO2的同时,生成2nmolNO
B.用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
C.混合气体的质量不再改变的状态
D.混合气体的平均相对分子质量不再改变的状态
查看答案和解析>>
科目: 来源: 题型:
【题目】某混合气体由一种气态烷烃和一种气态烯烃(含一个双键)组成,在同温同压下,混合气体对氢气的相对密度13,在标准状况下,将56L混合气体通入足量的溴水中,溴水的质量增重35g。
(1)计算确定混合气体中烃的化学式_____。
(2)混合气体中两种烃的物质的量之比_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见下表:
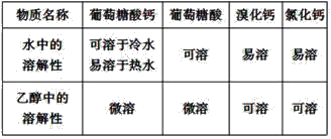
实验流程如下:
C6H12O6(aq)![]()
![]()
![]()
![]() 悬浊液
悬浊液![]()
![]()
![]() (C6H11O7)2Ca
(C6H11O7)2Ca
请回答下列问题:
(1)第①步中溴水氧化葡萄糖时,下列装置最适合的是__。
A.
B.
C.
(2)制备葡萄糖酸钙的过程中,葡萄糖氧化也可用其它试剂,下列物质中最适合的是__。
A.新制氢氧化铜悬浊液
B.酸性高锰酸钾溶液
C.氧气/葡萄糖氧化酶
D.银氨溶液
(3)第②步充分反应后碳酸钙固体需有剩余,其目的是__。
(4)第②步实验中不用氯化钙替代碳酸钙的理由是__。
(5)第③步需趁热过滤的原因是__。
(6)第④步加入乙醇的作用是__。
(7)第⑥步中,下列洗涤剂最合适的是__。
A.冷水 B.热水
C.乙醇 D.乙醇-水混合溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒容的密闭容器中进行下列可逆反应:C(s)+H2O(g)![]() CO(g)+H2(g);现有下列状态:①混合气体的密度不再改变;②各气体的浓度相等;③反应体系中温度保持不变(假设为绝热容器);④相同时间内,断裂H—O键的速率是断裂H—H键速率的2倍;其中能表明反应达到平衡状态的是
CO(g)+H2(g);现有下列状态:①混合气体的密度不再改变;②各气体的浓度相等;③反应体系中温度保持不变(假设为绝热容器);④相同时间内,断裂H—O键的速率是断裂H—H键速率的2倍;其中能表明反应达到平衡状态的是
A.①②③B.②③C.②③④D.①③④
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组用如图装置(支撑仪器略去)探究乙醇的催化氧化反应。
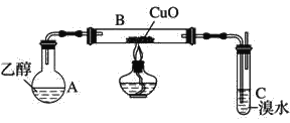
(1)实验开始时,对A进行水浴加热,其目的是__。
(2)B中反应方程式为__。
(3)若装置C中开始发生倒吸,则采取的应急措施是__(填编号)。
a.移去图中的酒精灯 b.将C中橡皮塞拔出
c.将B尾端的乳胶管取下 d.将A与B之间的乳胶管取下
(4)探究:充分反应后,观察到溴水完全褪色。学习小组通过测定反应前溴水中n(Br2)与反应后溶液中n(Br﹣)来确定乙醛使溴水褪色的原因。
①假设:请写出假设1的反应类型。
假设1:CH3CHO+Br2→CH2BrCHO+HBr__;
假设2:CH3CHO+Br2→CH3CHBrOBr 加成反应;
假设3:CH3CHO+Br2+H2O→CH3COOH+2HBr 氧化反应。
①结论:若实验测得n(Br2)=0.005mol,n(Br﹣)=0.01mol,则证明假设__正确。
查看答案和解析>>
科目: 来源: 题型:
【题目】目前,锂电池已扩展到镍酸锂、钴酸锂、硅碳负极、磷酸铁锂等电池体系。请回答下列问题:
(1)基态Ni原子的价电子排布式为________,与Ni同周期且基态原子核外的成单电子数与Ni相同的元素还有__________种。
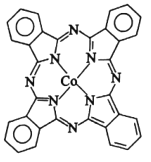
(2)酞菁钴分子的结构简式如图所示,中心离子为钴离子,分子中氮原子的杂化类型为___。
(3)Li+过度脱出易导致锂电池结构坍塌产生O2而爆炸。实验证实O2因具有单电子而成为顺磁性分子。下列结构式(黑点代表电子)中最有可能代表O2分子结构的是__(填字母)。
A ![]() B
B ![]() C
C ![]() D
D ![]()
(4)如图为SiO2晶胞中Si原子沿z轴方向在xy平面的投影图(即俯视投影图),其中O原子略去,Si原子旁标注的数字表示每个Si原子位于z轴的高度,则SiA与SiB的距离是______。
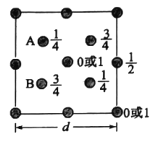
(5)PCl5晶体的晶胞如图所示,该晶体熔融时形成一种能导电的液体,实验测得其中含有一种正四面体阳离子和一种正八面体阴离子,且P—Cl键的键长只有198pm和206pm两种,试用电离方程式解释PCl5熔体能导电的原因____,正四面体形阳离子中键角大于PCl3的键角原因为_____。已知该晶体的晶胞边长为apm,NA为阿伏伽德罗常数的值,则该晶体的密度为__________g·cm-3。

查看答案和解析>>
科目: 来源: 题型:
【题目】生产医用防护口罩的原料聚丙烯纤维属于有机高分子材料,其单体为丙烯。丙烯除了合成聚丙烯外,还广泛用于制备1,2—二氯丙烷、丙烯醛、丙烯酸等。请回答下列问题:
Ⅰ.工业上用丙烯加成法制备1,2—二氯丙烷,主要副产物为3—氯丙烯,反应原理为:
①![]()
![]()
②![]()
![]()
(1)已知![]() 的活化能
的活化能![]() (逆)为
(逆)为![]() ,则该反应的
,则该反应的![]() (正)活化能为_____
(正)活化能为_____![]() 。
。
(2)一定温度下,向恒容密闭容器中充入等物质的量的![]() 和
和![]() ,在催化剂作用下发生反应①②,容器内气体的压强随时间的变化如下表所示。
,在催化剂作用下发生反应①②,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
用单位时间内气体分压的变化来表示反应速率,即![]() ,则反应①前180min内平均反应速率
,则反应①前180min内平均反应速率![]() ____
____![]() (保留小数点后2位)。
(保留小数点后2位)。
Ⅱ.丙烯的制备方法
方法一:丙烷无氧脱氢法制备丙烯反应如下:
![]()
![]()
(3)①某温度下,在刚性容器中充入![]() ,起始压强为10kPa,平衡时总压为14kPa,
,起始压强为10kPa,平衡时总压为14kPa,![]() 的平衡转化率为______。该反应的平衡常数
的平衡转化率为______。该反应的平衡常数![]() ______kPa(保留小数点后2位)。
______kPa(保留小数点后2位)。
②总压分别为100kPa、10kPa时发生该反应,平衡体系中![]() 和
和![]() 的物质的量分数随温度变化关系如图所示:
的物质的量分数随温度变化关系如图所示:
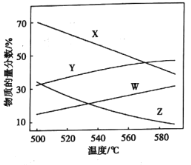
10kPa时,![]() 和
和![]() 的物质的量分数随温度变化关系的曲线分别是_____、______。
的物质的量分数随温度变化关系的曲线分别是_____、______。
方法二:丙烷氧化脱氢法制备丙烯还生成![]() 、
、![]() 等副产物,制备丙烯的反应如下:
等副产物,制备丙烯的反应如下:
![]()
![]() 。在催化剂作用下
。在催化剂作用下![]() 的转化率和
的转化率和![]() 的产率随温度变化关系如图所示。
的产率随温度变化关系如图所示。
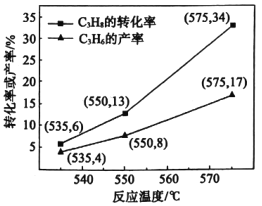
(4)①图中![]() 的转化率随温度升高而上升的原因是_________。
的转化率随温度升高而上升的原因是_________。
②575℃时,![]() 的选择性为___。(
的选择性为___。(![]() 的选择性=
的选择性=![]() )
)
③基于上述研究结果,能提高![]() 选择性的措施是______。
选择性的措施是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:
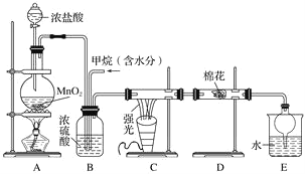
试回答下列问题:
(1)请写出C装置中生成CH3Cl的化学方程式:___________________________________。有人认为E中有氯化氢产生,不能证明甲烷与氯气发生了取代反应,你认为他的看法________(填“正确”或“不正确”)。
(2)B装置有三种功能:①控制气流速率;②混匀混合气体;③________________。
(3)一段时间后发现D装置中的棉花由白色变为蓝色,则棉花上可能预先滴有________溶液。
(4)E装置中除盐酸外,还含有机物,从E中分离出盐酸的最佳方法为________(填字母)。
a.分液法 b.蒸馏法 c.结晶法
(5)将1 mol CH4与Cl2发生取代反应,充分反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1 mol,则参加反应的Cl2的物质的量为________,生成HCl的总物质的量为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲烷的分子结构模型如图所示:

根据甲烷的分子结构模型,回答问题:
(1)甲烷的电子式是__,其含义是__。
(2)甲烷的结构式是__,其含义是_。
(3)甲烷分子的空间构型是__。
(4)更能真实反映甲烷分子结构模型的是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】柠檬酸(用H3R表示)是一种高效除垢剂。常温时,用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的物质的量百分数随pH的变化如图所示。下列说法正确的是
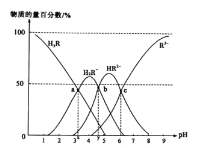
A.由a点判断H3R的第一步电离常数Ka1(H3R)的数量级为10-3
B.若b点溶液中金属阳离子只有Na+,则有c(Na+)=c(R3-)+c(HR2-)+c(H2R-)+c(H3R)
C.pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
D.反应2H2R-![]() H3R+HR2-在该温度下的平衡常数K=10x-y
H3R+HR2-在该温度下的平衡常数K=10x-y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com