
科目: 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu,25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:(友情提示:要将溶液中的![]() 、
、![]() 、
、![]() 、
、![]() 沉淀为氢氧化物,需溶液的pH分别为:6.4、6.4、3.7、4.7)
沉淀为氢氧化物,需溶液的pH分别为:6.4、6.4、3.7、4.7)
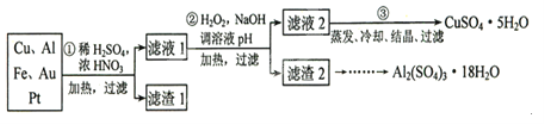
请回答下列问题:
(1)如何检验滤液1中是否含有![]() ?_______________;得到滤渣1的主要成分为____________。
?_______________;得到滤渣1的主要成分为____________。
(2)第2步加![]() 的作用是____________,使用
的作用是____________,使用![]() 的优点是____________;调溶液pH的目的是使____________生成沉淀。
的优点是____________;调溶液pH的目的是使____________生成沉淀。
(3)用第③步所得![]() 制备无水
制备无水![]() 的方法是____________。
的方法是____________。
(4)由滤渣2制取![]() ,探究小组设计了三种方案:
,探究小组设计了三种方案:
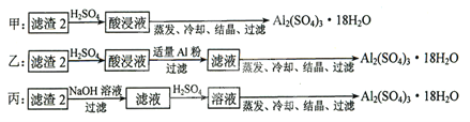
上述三种方案中,______方案不可行,原因是_________;从原子利用率角度考虑,______方案更合理。
(5)结晶水的测定:将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至250℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误:______________、______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生欲在实验室制备无水 FeCl3 并得到副产物 FeCl3 溶液。经查阅资料得知:无水 FeCl3 在空气中易潮解,加热易升华。如图是他设计的实验装置图(加热及夹持装置略去)
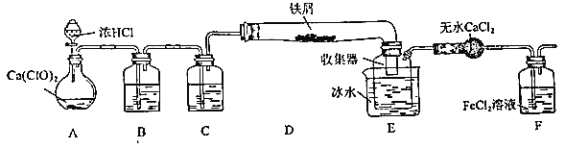
完成下列填空:
(1)装置 A 是 Cl2 发生装置,其中的化学反应方程式为_____
(2)B 中的溶液是_____,C 的作用是_____
(3)D 加热后,少量生成 FeCl3 沉积在D 的右端,要使沉积的 FeCl3 进入E,操作是______________
E 中冰水的作用为_____
(4)实验员老师对上述装置提出了 2 点改进建议:一是装置连接部分都改成标准玻璃接口,不用橡胶连接件的原因是_____;二是这套装置还存在一个很大的缺陷,改进的方法是_______________
(5)证明 F中 FeCl2 未被完全氧化的方法是_____
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于反应速率的说法中,正确的是
A.决定化学反应速率的因素是反应物本身的性质
B.对反应C(s)+CO2(g)![]() 2CO(g),其他条件不变时,增加C的量能使反应速率增大
2CO(g),其他条件不变时,增加C的量能使反应速率增大
C.其他条件相同时,反应温度升高,对于吸热反应,反应速率加快,对于放热反应,反应速率减慢
D.如图实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
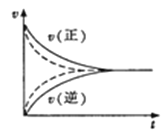
查看答案和解析>>
科目: 来源: 题型:
【题目】关于金属腐蚀的叙述中,正确的是( )
A.金属被腐蚀的本质是M+nH2O=M(OH)n+![]() H2↑
H2↑
B.马口铁(镀锡铁)镀层破损后被腐蚀时,首先是镀层被氧化
C.金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀
D.常温下,置于空气中的金属主要发生化学腐蚀
查看答案和解析>>
科目: 来源: 题型:
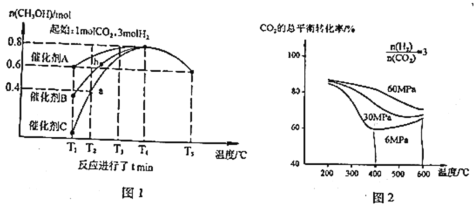
【题目】为应对全球气候变暖,科学家在综合利用 CO2 方面取得了不少研究成果。如用 CO2 合成重要化工原料 CH3OH,同时生成 CO,反应如下:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)+Q1kJ(Q1>0),
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g)-Q2kJ(Q2>0)。
研究催化剂等外界条件对上述反应的影响,结果如图 1、图 2
完成下列填空:
(1)一定是碳12的同位素原子是_____(选填“A”、“B”、“C”、“D”)
A.质子数为6,中子数为8 B.质子数为8,中子数为12
C.质子数为12,中子数为6 D.质子数为12,中子数为8
(2)分析图1:催化效果最佳的是催化剂_____(选填“A”、“B”、“C”)。若密闭容器体积为2L,则a点测得CH3OH的平均生成速率为_____mol·L-1·min-1。b点反应_____(填“达到”或“未达到”)平衡状态,理由是:_____
(3)分析图2:相同温度下,增大原料气压强,反应Ⅰ平衡常数_____(选填“增大”、“减小”、“不变”、“无法判断”);当压强为6Mpa、温度在400~600℃时,CO2的总体平衡转化率随温度升高而增大的原因是___________________________________
(4)若生成的CH3OH和CO物质的量之比为4:1,则消耗相同条件下的CO2和H2体积比是_____
(5)若有88gCO2发生反应Ⅰ,并放出akJ热量,则图3中A为_____,B为_____
查看答案和解析>>
科目: 来源: 题型:
【题目】分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇脱水是合成环己烯的常用方法,实验室合成环己烯的反应和实验装置如图:
![]()

可能用到的有关数据如下:

Ⅰ.合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
Ⅱ.分离提纯:
反应粗产物倒入分液漏斗中分别用少量5 %碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是__。
(2)加入碎瓷片的作用是__;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是__(填字母)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并__;在本实验分离过程中,产物应该从分液漏斗的__(填“上口倒出”或“下口倒出”)。
(4)分离提纯过程中加入无水氯化钙的目的是__。
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有__(填正确答案标号)。
A.蒸馏烧瓶 B.温度计 C.分液漏斗 D.牛角管 E.锥形瓶
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列实验仪器和实验操作的有关问题。


(1)图A中试管夹的作用是______________________。
(2)指出图B中的错误操作是____________________________________。
(3)图C、D是某同学配制50 g质量分数为6%的氯化钠溶液时,在称量和量取两个操作步骤中出现的情况:
①如图C所示:在称量氯化钠的操作过程中,发现指针偏右,则继续进行的操作是______________,至天平平衡。
②如图D所示,量取水时,仰视读数,所得溶液中溶质的质量分数会______________(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在0.2 L由NaCl溶液、MgCl2溶液、CuCl2溶液组成的混合溶液中,部分离子的浓度如图所示。
(1)混合液中,NaCl的物质的量为_______mol,MgCl2的质量为_______g。
(2)该混合溶液中CuCl2的物质的量浓度为_____molL﹣1,将该混合溶液加水稀释至体积为1 L,稀释后溶液中Cu2+的物质的量浓度为_______molL﹣1。

查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4 L氢气中含有2NA个中子
B. 0.1NA个氯化氢分子占有体积为2.24 L
C. 2克金属钙变成钙离子时失去的电子数为0.1NA
D. 50 mL 0.1 mol·L-1H2SO4溶液中含有H+数为0.005NA
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,a、b为等质量的电极,电解槽中盛有1 L 1.0 mol·L-1CuSO4溶液,电解前后溶液体积变化忽略不计,下列有关叙述正确的是
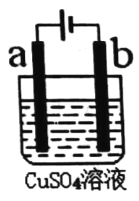
A.电子的流向:负极→b→a→正极
B.若为电解精炼铜装置,则a为粗铜;若为电镀铜装置,则b为纯铜
C.电镀铜或电解精炼铜,溶液中Cu2+浓度均不变
D.若为电镀铜,当电路中通过的电子为0.2mol时,两极的质量相差12.8g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com