
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu,25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:(友情提示:要将溶液中的![]() 、
、![]() 、
、![]() 、
、![]() 沉淀为氢氧化物,需溶液的pH分别为:6.4、6.4、3.7、4.7)
沉淀为氢氧化物,需溶液的pH分别为:6.4、6.4、3.7、4.7)
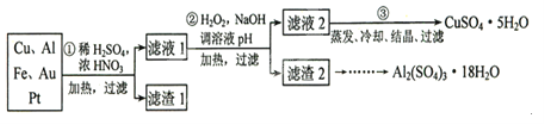
请回答下列问题:
(1)如何检验滤液1中是否含有![]() ?_______________;得到滤渣1的主要成分为____________。
?_______________;得到滤渣1的主要成分为____________。
(2)第2步加![]() 的作用是____________,使用
的作用是____________,使用![]() 的优点是____________;调溶液pH的目的是使____________生成沉淀。
的优点是____________;调溶液pH的目的是使____________生成沉淀。
(3)用第③步所得![]() 制备无水
制备无水![]() 的方法是____________。
的方法是____________。
(4)由滤渣2制取![]() ,探究小组设计了三种方案:
,探究小组设计了三种方案:
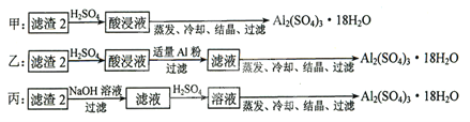
上述三种方案中,______方案不可行,原因是_________;从原子利用率角度考虑,______方案更合理。
(5)结晶水的测定:将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至250℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误:______________、______________。
【答案】取少量滤液1于试管中,加入KSCN溶液,若溶液呈现血红色就证明有![]() ,若溶液没有呈现血红色就无
,若溶液没有呈现血红色就无![]() Pt、Au 将
Pt、Au 将![]() 氧化为
氧化为![]() 不引入杂质,对环境无污染
不引入杂质,对环境无污染 ![]() 、
、![]() 加热脱水 甲 所得产品中含有较多
加热脱水 甲 所得产品中含有较多![]() 杂质 乙 样品加热后不应置于空气中冷却,应置于干燥器中冷却 样品“加热、冷却、称量”需进行多次直至恒重
杂质 乙 样品加热后不应置于空气中冷却,应置于干燥器中冷却 样品“加热、冷却、称量”需进行多次直至恒重
【解析】
在浓硝酸、稀硫酸和加热条件下,Cu、Al、Fe溶解,Au、Pt不溶解,经过滤得滤渣1为Au、Pt,滤液1为含Cu2+、Al3+、Fe2+、Fe3+、SO42-等离子的溶液,滤液1加H2O2将Fe2+氧化成Fe3+,然后加NaOH调pH到4.7将Al3+沉淀,同时Fe3+也被沉淀,得滤渣2为Al(OH)3和Fe(OH)3、滤液2主要含CuSO4溶液,滤液2经蒸发浓缩、冷却结晶、过滤得CuSO4·5H2O,滤渣2经一系列操作得![]() ,据此解答。
,据此解答。
(1)Fe3+用KSCN溶液检验,具体方法为:取少量滤液1于试管中,加入KSCN溶液,若溶液呈现血红色就证明有![]() ,若溶液没有呈现血红色就无Fe3+,滤渣1的主要成分为不溶于硝酸和硫酸的Pt、Au,故答案为:取少量滤液1于试管中,加入KSCN溶液,若溶液呈现血红色就证明有
,若溶液没有呈现血红色就无Fe3+,滤渣1的主要成分为不溶于硝酸和硫酸的Pt、Au,故答案为:取少量滤液1于试管中,加入KSCN溶液,若溶液呈现血红色就证明有![]() ,若溶液没有呈现血红色就无Fe3+;Pt、Au;
,若溶液没有呈现血红色就无Fe3+;Pt、Au;
(2)加H2O2的作用是将![]() 氧化为
氧化为![]() ,优点是还原产物为H2O,既不引入杂质,也不会对环境造成污染,调pH的目的是使
,优点是还原产物为H2O,既不引入杂质,也不会对环境造成污染,调pH的目的是使![]() 、
、![]() 形成沉淀,故答案为:将
形成沉淀,故答案为:将![]() 氧化为
氧化为![]() ;还原产物为H2O,既不引入杂质,也不会对环境造成污染;
;还原产物为H2O,既不引入杂质,也不会对环境造成污染;![]() 、
、![]() ;
;
(3)将![]() 加热脱水可制备无水
加热脱水可制备无水![]() ,故答案为:加热脱水;
,故答案为:加热脱水;
(4)滤渣2为Al(OH)3和Fe(OH)3,若用甲方案,所得产物中将含较多的![]() 杂质,故甲方案不可行,丙方案中有硫酸钠生成,所以原子利用率不如乙方案,故答案为:甲;所得产品中含有较多
杂质,故甲方案不可行,丙方案中有硫酸钠生成,所以原子利用率不如乙方案,故答案为:甲;所得产品中含有较多![]() 杂质;乙;
杂质;乙;
(5)空气中有水蒸气,样品加热后不应置于空气中冷却,应置于干燥器中冷却,样品“加热、冷却、称量”需进行多次直至恒重,故答案为:样品加热后不应置于空气中冷却,应置于干燥器中冷却;样品“加热、冷却、称量”需进行多次直至恒重。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】如图所示是制取无水氯化铜的实验装置图,将浓盐酸滴加到盛有二氧化锰粉末的圆底烧瓶中。请回答下列问题:

(1)盛放浓盐酸的仪器名称为__。
(2)烧瓶中发生反应的离子方程式为__。
(3)C瓶中的试剂是__,其作用是__。
(4)玻璃管D中发生反应的化学方程式是__,反应现象是__。
(5)干燥管E中盛有碱石灰(CaO+NaOH),其作用是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-905.9kJ·mol-1。下列叙述正确的是
4NO(g)+6H2O(g) △H=-905.9kJ·mol-1。下列叙述正确的是
A.4molNH3和5molO2反应,达到平衡时放出热量为905.9kJ
B.平衡时,5v正(O2)=4v逆(NO)
C.平衡后降低压强,混合气体平均摩尔质量增大
D.平衡后升高温度,混合气体中NO含量降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图所示原电池的说法正确的是
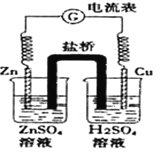
A. 随着反应进行,左烧杯中盐溶液浓度上升,右烧杯中酸溶液浓度下降
B. 盐桥的作用是让电子通过,以构成闭合回路
C. 随着反应进行,右烧杯中溶液pH变小
D. 总反应为:2H++ Zn ="==" H2↑+ Zn2+△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇脱水是合成环己烯的常用方法,实验室合成环己烯的反应和实验装置如图:
![]()

可能用到的有关数据如下:

Ⅰ.合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
Ⅱ.分离提纯:
反应粗产物倒入分液漏斗中分别用少量5 %碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是__。
(2)加入碎瓷片的作用是__;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是__(填字母)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并__;在本实验分离过程中,产物应该从分液漏斗的__(填“上口倒出”或“下口倒出”)。
(4)分离提纯过程中加入无水氯化钙的目的是__。
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有__(填正确答案标号)。
A.蒸馏烧瓶 B.温度计 C.分液漏斗 D.牛角管 E.锥形瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香叶醇是合成玫瑰香油的主要原料,其结构简式如下:
![]()
下列有关香叶醇的叙述正确的是( )
A.香叶醇的分子式为C10H18O
B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪色
D.能燃烧,其产物一定为二氧化碳和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.向NaAlO2溶液中通入过量CO2:![]()
B.铝与氯化铜溶液反应:![]()
C.次氯酸钙溶液中通入SO2气体:![]()
D.在溶液中NH4HCO3与NaOH以等物质的量混合:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g)+bB(g)![]() cC(g) △H= -Q kJmol-1(Q>0),12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如图所示。试计算:
cC(g) △H= -Q kJmol-1(Q>0),12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如图所示。试计算:
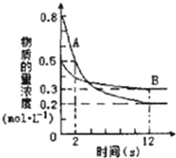
(1)前12s内,A的平均反应速率为______________。
(2)化学计量数之比b:c=______________。
(3)12s内,A和B反应放出的热量为__________(用Q表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I是制备预防髋或膝关节置换术后静脉血栓栓塞药物的医药中间体。其一种合成路线如图:
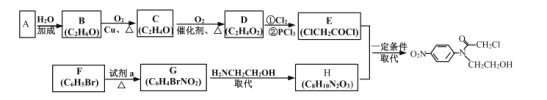
请回答下列问题:
(1)G中官能团的名称为__;C的化学名称为__。
(2)C→D的反应类型为__。
(3)F→G所需的试剂![]() 为__。
为__。
(4)G→H的化学方程式为__。
(5)M为H的同分异构体,同时满足下列条件的M有__种(不考虑立体构);其中核磁共振氢谱显示6种不同环境的氢,且峰面积之比为1:1:1:1:2:4的结构简式为__(写出任意一种)。
①苯环上有三个取代基且其中两个为氨基
②1molM分别与足量Na或NaHCO3溶液反应,均能产生气体且生成气体的物质的量相同。
(6)参照上述流程和信息,设计以甲苯和H2NCH2CH2OCH2COCl为原料(无机试剂任选)制备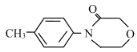 的合成路线:__。
的合成路线:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com