
科目: 来源: 题型:
【题目】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO![]() 等)制备K2Cr2O7的流程如图所示。
等)制备K2Cr2O7的流程如图所示。
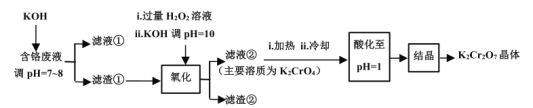
已知:I.在酸性条件下,H2O2能将Cr2O![]() 还原为Cr3+;
还原为Cr3+;
Ⅱ.相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Cr3+ | 4.9 | 6.8 |
Fe3+ | 1.5 | 2.8 |
请回答下列问题:
(1)滤渣①的主要成分__。
(2)加入H2O2的作用是(用离子方程式解释)__。
(3)加热的目的是__。
(4)“酸化”过程中发生反应的离子方程式为__;若该反应的平衡常数K=4×1014L3·mol-3,已知:“酸化”后溶液中c(Cr2O![]() )=1.6×10-3mol·L-1,则溶液中c(CrO
)=1.6×10-3mol·L-1,则溶液中c(CrO![]() )=__。
)=__。
(5)“结晶”后得到K2Cr2O7(M=294g·mol-1)产品0.6000g,将其溶解后用稀H2SO4酸化,再用浓度为0.01000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定,滴定反应为:Cr2O![]() +6Fe2++14H+=2Cr3++6Fe3++7H2O,滴定终点消耗标准溶液的体积为900mL,则产品的纯度为__。(计算结果保留四位有效数字)
+6Fe2++14H+=2Cr3++6Fe3++7H2O,滴定终点消耗标准溶液的体积为900mL,则产品的纯度为__。(计算结果保留四位有效数字)
(6)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚(C6H5OH)废水的有效处理,其工作原理如图所示。
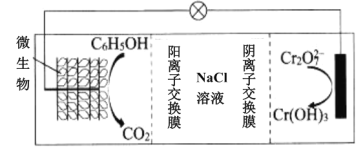
①负极的电极反应式为__;
②一段时间后,中间室中NaCl溶液的浓度__(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】计算填空:
(1)配制500 mL 0.5 mol·L-1的硫酸铜溶液,所需胆矾的质量是____________。
(2)将58.5 g 氯化钠溶于水配成500 mL溶液,其物质的量浓度是__________。
(3)中和100 mL 1 mol·L-1的硫酸,需氢氧化钠的质量是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有一处于平衡状态的反应X(g) +3Y(g)![]() 2Z(g) (正反应是放热反应) 。为了使平衡向生成Z的方向移动, 应选择的条件是
2Z(g) (正反应是放热反应) 。为了使平衡向生成Z的方向移动, 应选择的条件是
①升高温度 ②降低温度 ③增大压强 ④降低压强 ⑤加入正催化剂 ⑥分离出Z
A. ①③⑤ B. ②③⑤ C. ②③⑥ D. ②④⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20mL0.1mol·L-1的HA溶液中逐滴加入0.1mol·L-1的烧碱溶液,溶液中水所电离的c水(H+)随加入烧碱溶液体积的变化如图所示,下列说法正确的是( )
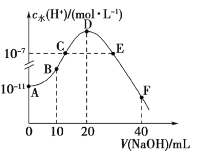
A.B点的溶液中粒子浓度之间存在:c(HA)>c(Na+)>c(A-)
B.由图可知A-的水解平衡常数Kh约为1×10-9
C.C、E两点因为对水的电离的抑制作用和促进作用相同,所以溶液均呈中性
D.F点的溶液呈碱性,粒子浓度之间存在:c(OH-)=c(HA)+c(A-)+c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) ![]() 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
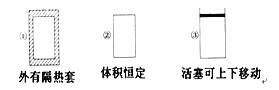
A. ③②①B. ③①②C. ①②③D. ②①③
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-===2Mn2++10CO2↑+8H2O
B. Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
C. 惰性电极电解MgCl2溶液:2Cl+2H2O![]() Cl2↑+2OH-+ H2↑
Cl2↑+2OH-+ H2↑
D. 向NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH- ===BaSO4↓+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g) ΔH<0。如图表示该反应的反应速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
2Z(g) ΔH<0。如图表示该反应的反应速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
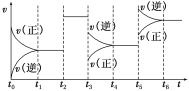
A.t2时加入了催化剂B.t3时降低了温度
C.t5时增大了压强D.t4~t5时间段内反应物转化率最小
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,1mol甲基(-14CD3)所含的中子数和电子数分别为11NA、9NA
B.CH4和P4都是正四面体结构,物质的量相同的CH4和P4的共价键数之比为![]()
C.标准状态下,1molH2和1molF2混合后,所含气体的体积为44.8L
D.常温常压下,0.5molFe和足量浓硝酸混合,转移电子数为1.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,在27.5 g水中溶解12.5 g CuSO45H2O,恰好达到饱和,该溶液密度为1.18 g·cm-3,求:
(1)该溶液中阴阳离子的总物质的量._________________
(2)该溶液中CuSO4的物质的量浓度(保留二位小数)。________________
(3)取出20.0 mL该溶液,加入足量Ba(OH)2溶液,反应后可得到沉淀质量多少克?(保留一位小数)____________
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,40 g、10%硝酸钠溶液与60 g、7.5%的硝酸钠溶液混合,得到密度为1.20 g·cm-3的混合溶液,计算:
(1)该混合溶液中溶质的质量分数为__;
(2)该混合溶液中NaNO3的物质的量浓度为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com