
【题目】某密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g) ΔH<0。如图表示该反应的反应速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
2Z(g) ΔH<0。如图表示该反应的反应速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
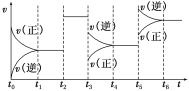
A.t2时加入了催化剂B.t3时降低了温度
C.t5时增大了压强D.t4~t5时间段内反应物转化率最小
【答案】A
【解析】
A.由图可知,t2时刻,改变了外界条件,正、逆反应速率同等程度增大,平衡不移动。由于该反应正反应是气体体积减小的反应,所以改变条件只能是使用催化剂,A正确;
B.t3时刻,改变外界条件,使正、逆反应速率都降低,且正反应速率降低更多,平衡向逆反应移动。由于该反应正反应是放热反应,温度降低,平衡向正反应移动,故改变的外界条件不可能为降低温度,B错误;
C.t5时刻,改变外界条件,使正、逆反应速率都增大,且逆反应速率增大更多,平衡向逆反应移动。由于该反应正反应是气体体积减小的反应,增大压强平衡向正反应移动,与图象不符合,C错误;
D.由上述分析可知,t2时刻,使用催化剂,平衡不移动,X的转化率不变,t3时刻,减小压强,平衡向逆反应移动,X的转化率降低,t5时刻,升高温度,平衡向逆反应移动,X的转化率继续降低,故在t6时刻,X的转化率最低,D错误;
故合理选项是A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】现有未知浓度的盐酸25 mL,能跟20 mL某浓度的氢氧化钠溶液完全反应。若先用0.1 g 碳酸钙与25 mL这种酸作用,剩余的酸需用上述氢氧化钠溶液4 mL才能中和。求盐酸和氢氧化钠溶液中溶质的物质的量浓度分别是多少?______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题
(1)某蓄电池的正负极标志难以辨别,请设计实验方案,将蓄电池的正负极辨别出来____________________。
(2)解释下列化学反应的反应速率变化关系曲线
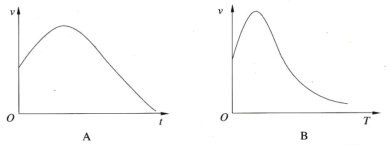
①将除去氧化膜的镁条投入盛有稀盐酸的试管中,产生氢气的速率随时间的变化关系如图A所示,试解释原因:_________________________________________________________。
②过氧化氢在酶的催化作用下的分解速率随温度的变化关系如图B所示,试解释原因:______________________。
(3)氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。
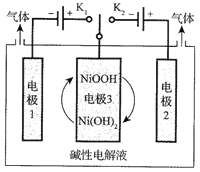
①制H2时,连接_______________。
②改变开关连接方式,可得O2,电极反应式为___________________________。
③结合①和②中电极3的电极反应式,说明电极3的作用:______________________________。
(4)甲醇燃料电池DMFC可作电脑、汽车的能量来源。在实验室完成一个实验,用DMFC电解NaClO3溶液可制取NaClO4溶液,装置如图所示(其中DMFC以KOH作电解质)。
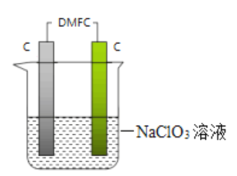
①写出电源负极电极反应式:______________________________。
②写出电解的总反应化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验发现,298 K时,在氯化铁酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+。某夏令营兴趣小组根据该实验事实设计了如图所示原电池装置。下列有关说法正确的是

A. 该原电池的正极反应是:Zn-2e-=Zn2+
B. 左烧杯中溶液的红色逐渐褪去
C. 该电池铂电极上立即有气泡出现
D. 该电池总反应为:3Zn+2Fe3+=2Fe+3Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫沙朵林![]() 是一种镇痛药,它的合成路线如下:
是一种镇痛药,它的合成路线如下:
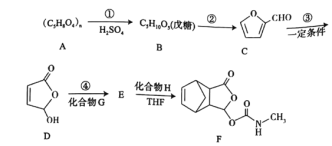
已知:有机化合物中与四个各不相同原子或基团相连的碳原子称手性碳原子。
请回答下列问题:
(1)已知①是水解反应,则![]() 分子中手性碳原子数是________。
分子中手性碳原子数是________。
(2)![]() 在加热、盐酸催化的条件下生成
在加热、盐酸催化的条件下生成![]() ,写出②的化学方程式________。
,写出②的化学方程式________。
(3)有机物![]() 中含氧官能团的名称为________。
中含氧官能团的名称为________。
(4)化合物![]() 的结构简式为
的结构简式为![]() ,则
,则![]() 的反应类型为________,反应④是绿色化学中最理想的“原子经济”反应,化合物
的反应类型为________,反应④是绿色化学中最理想的“原子经济”反应,化合物![]() 的分子式为________。
的分子式为________。
(5)同时满足下列条件的![]() 的同分异构体有________种。
的同分异构体有________种。
①核磁共振氢谱有4个峰;②能发生银镜反应和水解反应;③与![]() 溶液发生显色反应
溶液发生显色反应
(6)下列有关莫沙朵林![]() 的说法正确的是________。
的说法正确的是________。
A.可以发生水解、取代、氧化
B.![]() 分子只有一个五元碳环
分子只有一个五元碳环
C.![]() 莫沙朵林最多可以消耗
莫沙朵林最多可以消耗![]()
D.能使溴的四氯化碳溶液褪色
(7)已知:![]() 设计由
设计由![]() 制备
制备![]() 的合成路线________。
的合成路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算填空:
(1)配制500 mL 0.5 mol·L-1的硫酸铜溶液,所需胆矾的质量是____________。
(2)将58.5 g 氯化钠溶于水配成500 mL溶液,其物质的量浓度是__________。
(3)中和100 mL 1 mol·L-1的硫酸,需氢氧化钠的质量是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不属于氧化还原反应的是
A.H2+CuO![]() H2O+Cu
H2O+Cu
B.Cl2+2NaOH=NaCl+NaClO+H2O
C.2Na2O2+2H2O=4NaOH+O2↑
D.Ca(OH)2+2HCl=CaCl2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2分别通入无氧、有氧的浓度均为0.1 mol·L-1的 BaCl2溶液和Ba(NO3)2溶液中,探究体系中微粒间的相互作用,实验记录如下:
实验记录 | |
pH变化 |
|
溶液中是否产生沉淀 | BaCl2溶液(无氧)中无白色沉淀、BaCl2溶液(有氧)中有白色沉淀 Ba(NO3)2溶液(无氧)中有白色沉淀、Ba(NO3)2溶液(有氧)中有白色沉淀 |
下列说法不正确的是
A.曲线a 所示溶液pH降低的原因:SO2 + H2O![]() H2SO3
H2SO3![]() H+ + HSO3-
H+ + HSO3-
B.曲线c 所示溶液中发生反应:2Ba2+ + O2 + 2SO2 + 2H2O =2BaSO4↓+ 4H+
C.与曲线a、b、c对比,可知曲线d所表示的过程中NO3-是氧化SO2的主要微粒
D.依据该实验预测0.2 mol·L-1的KNO3溶液(无氧)也可以氧化SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ/mol
O2(g)=H2O(l) ΔH=-285.8 kJ/mol
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ/mol
O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③C(s)+![]() O2(g)=CO(g) ΔH=-110.5 kJ/mol
O2(g)=CO(g) ΔH=-110.5 kJ/mol
④C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列各问题:
(1)上述反应中属于放热反应的是________。
(2)表示H2的燃烧热的化学方程式为________;表示C的燃烧热的化学方程式为_______。
(3)燃烧10 g H2生成液态水,放出的热量为__________。
(4)CO的燃烧热为__________;其热化学方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com