
【题目】莫沙朵林![]() 是一种镇痛药,它的合成路线如下:
是一种镇痛药,它的合成路线如下:
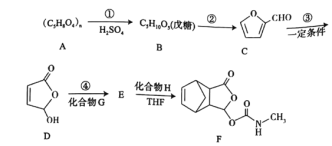
已知:有机化合物中与四个各不相同原子或基团相连的碳原子称手性碳原子。
请回答下列问题:
(1)已知①是水解反应,则![]() 分子中手性碳原子数是________。
分子中手性碳原子数是________。
(2)![]() 在加热、盐酸催化的条件下生成
在加热、盐酸催化的条件下生成![]() ,写出②的化学方程式________。
,写出②的化学方程式________。
(3)有机物![]() 中含氧官能团的名称为________。
中含氧官能团的名称为________。
(4)化合物![]() 的结构简式为
的结构简式为![]() ,则
,则![]() 的反应类型为________,反应④是绿色化学中最理想的“原子经济”反应,化合物
的反应类型为________,反应④是绿色化学中最理想的“原子经济”反应,化合物![]() 的分子式为________。
的分子式为________。
(5)同时满足下列条件的![]() 的同分异构体有________种。
的同分异构体有________种。
①核磁共振氢谱有4个峰;②能发生银镜反应和水解反应;③与![]() 溶液发生显色反应
溶液发生显色反应
(6)下列有关莫沙朵林![]() 的说法正确的是________。
的说法正确的是________。
A.可以发生水解、取代、氧化
B.![]() 分子只有一个五元碳环
分子只有一个五元碳环
C.![]() 莫沙朵林最多可以消耗
莫沙朵林最多可以消耗![]()
D.能使溴的四氯化碳溶液褪色
(7)已知:![]() 设计由
设计由![]() 制备
制备![]() 的合成路线________。
的合成路线________。
【答案】3 
![]() 酯基、羟基 加成反应
酯基、羟基 加成反应 ![]() 2
2 ![]()
【解析】
A经过①水解反应,得到B戊糖,B经过②得到C,C为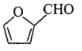 ,可知B为:
,可知B为: ;C经过③,得到D
;C经过③,得到D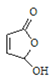 ,F的结构简式为
,F的结构简式为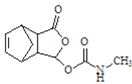 ,由题可知H为
,由题可知H为![]() ,可推出E为
,可推出E为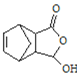 ;D与G反应,经过④得到E,则G为
;D与G反应,经过④得到E,则G为![]() ,据此作答。
,据此作答。
(1)根据分析B物质的结构简式可知,分子中含有3个手性碳原子,即![]() ,故答案为:3;
,故答案为:3;
(2)B 在加热、盐酸催化的条件下生成C
在加热、盐酸催化的条件下生成C ,则②的化学方程式为
,则②的化学方程式为
![]() ,故答案为:
,故答案为:
![]() ;
;
(3)根据D的结构简式可知,化合物D中含氧官能团的名称为酯基、羟基,故答案为: 酯基、羟基;
(4)根据![]() 的结构简式并根据原子守恒可知,该反应应该是加成反应;根据分析可知G为
的结构简式并根据原子守恒可知,该反应应该是加成反应;根据分析可知G为![]() ,则分子式为
,则分子式为![]() ,故答案为:加成反应;
,故答案为:加成反应;![]() ;
;
(5)能发生银镜反应和水解反应,这说明分子中含有酯基和醛基;能与FeCl3溶液发生显色反应,说明分子中含有酚羟基;又因为核磁共振氢谱有4个峰,所以应该是甲酸形成的酯,则可能的结构简式有 两种,故答案为:2;
两种,故答案为:2;
(6) A.F中含有酯基,可以发生水解反应,含有酰胺并且氮上有氢,可以发生取代反应,含有碳碳双键,可以发生氧化反应,故A项正确;
B. 根据F的结构简式可知,分子只有三个五元碳环,故B项错误;
C.1mol莫沙朵林含有2个酯基和1个酰胺,最多可以消耗3molNaOH,故C项错误;
D. F中含有碳碳双键,能使溴的四氯化碳溶液褪色,故D项正确;
综上正确的为AD,故答案为:AD;
(7)![]() 可发生催化氧化生成
可发生催化氧化生成![]() ,然后发生消去反应生成
,然后发生消去反应生成![]() ,然后发生取代反应生成
,然后发生取代反应生成![]() ,进而与
,进而与![]() 作用可生成目标物,反应流程为
作用可生成目标物,反应流程为 ,故答案为:
,故答案为: 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在25℃、101kPa的条件下,断裂1 molH—H键吸收436 kJ能量,断裂1mol Cl—Cl键吸收243kJ能量,形成1 molH—Cl键放出431 kJ能量。
H2+Cl2===2HCl的化学反应可用如图表示:
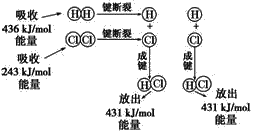
请回答下列有关问题:
(1)反应物断键吸收的总能量为____。
(2)生成物成键放出的总能量为____。
(3)1molH2和1molCl2反应生成2molHCl是_____(填“吸收”或“放出”)能量的反应,其能量值为____。
(4)反应物总能量___(填“>”或“<”)生成物总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】面对新冠肺炎病毒可以采用的消毒剂常见的有“84”消毒液,医用酒精它们的有效成分分别是NaClO、![]() ,都可以使病毒中的蛋白质变性,从而杀死病毒。请回答以下问题:
,都可以使病毒中的蛋白质变性,从而杀死病毒。请回答以下问题:
(1)以上涉及元素包含______个主族、______个周期;按原子半径由小到大排列依次为____________(用元素符号表示);有2个未成对电子元素是______;非金属性:O>Cl,请列举一个事实________________________。
(2)![]() 是______(“电解质”,“非电解质”);75%酒精的“75%”是______(“质量分数分数”,“体积分数”),
是______(“电解质”,“非电解质”);75%酒精的“75%”是______(“质量分数分数”,“体积分数”),![]() 分子中的氢原子的类型有______种(“2”,“3”或“4”)。
分子中的氢原子的类型有______种(“2”,“3”或“4”)。
(3)NaClO的电子式______,其溶液中的离子浓度由大到小顺序__________________。某化学工作者在家自制“84”消毒液如图

(4)①M的化学式______,铁是______极;②请阐述该装置能够制取消毒液的理由:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积相同的两个容器中,充入等质量CO2和CO气体,下列判断正确的是( )
A.CO2和CO对容器产生的压强之比是7∶11
B.CO2和CO的密度之比是11∶7
C.CO2和CO的分子数相等
D.CO2和CO的氧原子个数比是22∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴是熔点高的金属,可与氯气反应制氯化钴![]() ,氯化钴易潮解,可用于催化剂的制备、氨的吸收等。制备氯化钴的装置如图所示。
,氯化钴易潮解,可用于催化剂的制备、氨的吸收等。制备氯化钴的装置如图所示。
已知:![]() 的氧化性强于
的氧化性强于![]() 。
。
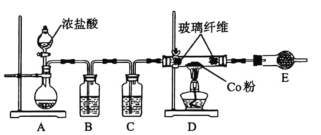
(1)检查![]() 装置气密性的方法:用止水夹夹住
装置气密性的方法:用止水夹夹住![]() 、
、![]() 之间的橡皮管,向分液漏斗中加水,________(将步骤补充完整),证明装置
之间的橡皮管,向分液漏斗中加水,________(将步骤补充完整),证明装置![]() 气密性良好。
气密性良好。
(2)装置![]() 烧瓶中的固体为漂粉精,烧瓶中发生反应的化学方程式________。
烧瓶中的固体为漂粉精,烧瓶中发生反应的化学方程式________。
(3)装置![]() 的洗气瓶中盛放的试剂是________,装置
的洗气瓶中盛放的试剂是________,装置![]() 硬质玻璃管中的玻璃纤维的作用是________。
硬质玻璃管中的玻璃纤维的作用是________。
(4)![]() 中物质的名称________,其作用是________。
中物质的名称________,其作用是________。
(5)钴有多种氧化物,![]() 与浓盐酸反应的离子方程式是________。
与浓盐酸反应的离子方程式是________。
(6)氯化钴溶液与氯化铝溶液类似,直接蒸干不能得到![]() 固体,使氯化亚砜
固体,使氯化亚砜![]() 与
与![]() 混合加热可以得到氯化钴固体,原因是________。
混合加热可以得到氯化钴固体,原因是________。
(7)向氯化钴溶液中加入草酸钠![]() ,生成草酸钴晶体
,生成草酸钴晶体![]() ,将草酸钴晶体在空气中充分加热,将反应生成的气态物质通人澄清石灰水中生成沉淀的质量为的
,将草酸钴晶体在空气中充分加热,将反应生成的气态物质通人澄清石灰水中生成沉淀的质量为的![]() ,剩余固体为钴的某种氧化物,其质量为
,剩余固体为钴的某种氧化物,其质量为![]() ,计算确定钴的氧化物的化学式是________。
,计算确定钴的氧化物的化学式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g) ΔH<0。如图表示该反应的反应速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
2Z(g) ΔH<0。如图表示该反应的反应速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
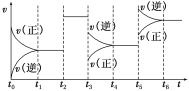
A.t2时加入了催化剂B.t3时降低了温度
C.t5时增大了压强D.t4~t5时间段内反应物转化率最小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
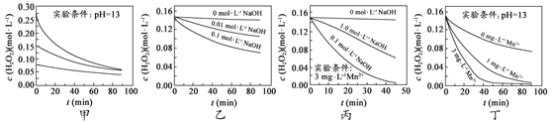
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2(g) ![]() N2O4(g) ΔH<0)
N2O4(g) ΔH<0)
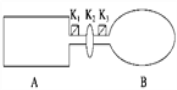
(1)一段时间后,反应达到平衡,此时A、B中生成N2O4的速率是vA______vB(填“>”、“<”或“=”);若打开活塞K2,气球B将______(填“变大”、“变小”或“不变”).
(2)关闭活塞K2,若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将________(填“增大”、“减小”或“不变”);若分别通入等量的氖气,则达到平衡时,A中NO2的转化率将________,B中NO2的转化率将______(填“变大”、“变小”或“不变”).
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,______中的颜色较深.
(4)若在容器A中充入4.6 g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4 kJ·mol-1,在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
2NH3(g)ΔH=-92.4 kJ·mol-1,在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
(1)测得反应放出的热量_________92.4kJ。(填“小于”,“大于”或“等于”)
(2)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是___________。
(3)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________。(填“变大”、“变小”或“不变”)
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将___________(填“正向”、“逆向”或“不”)移动。
(5)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将____________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com