
科目: 来源: 题型:
【题目】甲烷水蒸气重整制取的合成气可用于熔融碳酸盐燃料电池。
(1)制取合成气的反应为CH4(g)+H2O(g)![]() CO(g)+3H2(g)H =+206 kJ/mol。
CO(g)+3H2(g)H =+206 kJ/mol。
向体积为2 L密闭容器中,按n(H2O)∶n(CH4)=1投料:
a.保持温度为T1时,测得CH4(g)的浓度随时间变化曲线如图1所示。
b.其他条件相同时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应相同时间后,CH4的转化率随反应温度的变化如图2所示。

①结合图1,写出反应达平衡的过程中的能量变化:______kJ。
②在图1中画出:起始条件相同,保持温度为T2(T2> T1)时, c(CH4)随时间的变化曲线______。
③根据图2判断:
ⅰ. a点所处的状态不是化学平衡状态,理由是_______。
ⅱ. CH4的转化率:c>b,原因是________。
(2)熔融碳酸盐燃料电池的结构示意图如下。

①电池工作时,熔融碳酸盐中CO32-移向________(填“电极A”或“电极B”)
②写出正极上的电极反应:________。
(3)若不考虑副反应,1 kg甲烷完全转化所得到的合成气全部用于燃料电池中,外电路通过的电子的物质的量最大为_____mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验小组利用传感器探究Na2CO3和NaHCO3的性质。
实验操作 | 实验数据 |
测量下述实验过程的pH变化
|
|
下列分析不正确的是
A.①与②的实验数据基本相同,说明②中的OH-未参与该反应
B.加入试剂体积相同时,②所得沉淀质量大于③所得沉淀质量
C.从起始到a点过程中反应的离子方程式为:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-
D.b点对应溶液中水的电离程度小于c点对应溶液中水的电离程度
查看答案和解析>>
科目: 来源: 题型:
【题目】将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答下列问题:
(1)NO的体积为________L,NO2的体积为________L。
(2)参加反应的HNO3的物质的量是________。
(3)待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________mol·L-1。
(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水________g。
(5)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要通O2______mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作____。
(2)某学习小组设计用如下图装置验证二氧化硫的化学性质。


(3)能说明SO2具有氧化性的实验现象为_________________。
(4)为验证SO2的还原性,充分反应后,取试管b中溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色退去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是________(填“Ⅰ”“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关甲、乙、丙、丁四个图示的叙述正确的是( )
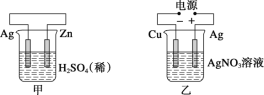
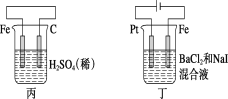
A.甲中负极反应式为2H++2e-=H2↑
B.乙中阳极反应式为Ag++e-=Ag
C.丙中H+向碳棒方向移动
D.丁中电解开始时阳极产生黄绿色气体
查看答案和解析>>
科目: 来源: 题型:
【题目】喷泉实验是中学化学的重要实验。
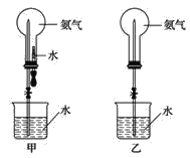
(1)实验室中常用图甲装置进行NH3的喷泉实验。用该装置完成喷泉实验的操作方法是_________。
(2)若用图乙装置进行NH3的喷泉实验,打开止水夹后,烧杯中的液体不能进入烧瓶。请写出引发喷泉实验的一种操作方法:____________。
(3)若将图甲装置中胶头滴管和烧杯中液体改为NaOH溶液,能用改动后的甲装置进行喷泉实验的一组气体是_________(填字母)。
A.HCl和CO2 B.Cl2和CO C.O2和SO2 D.NO2和NO
查看答案和解析>>
科目: 来源: 题型:
【题目】如下图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是

A. Pt为阴极,Cu为阳极
B. b极的电极反应式是2H++2e-=H2↑
C. 电解过程中CuSO4溶液的pH逐渐增大
D. Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:Br2常温下呈液态、易挥发、有毒。如图为实验室模拟工业过程从浓缩的海水中提取溴的实验装置。
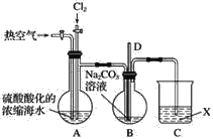
其实验步骤如下:
Ⅰ.在烧瓶中加入硫酸酸化的浓缩海水,持续通入Cl2一段时间,溶液变为浅棕色后,停止通入Cl2,改通入热空气;
Ⅱ.当A与B烧瓶溶液均变为无色的时候,停止通入热空气;
Ⅲ.将烧瓶B中的溶液倒入分液漏斗,加入稀硫酸酸化后,用CC14萃取,再经过蒸馏分离提取出其中的溴。
请回答:
(1)烧瓶A中通入Cl2过程中发生反应的离子方程式为_______________________。
(2)步骤Ⅰ中通入热空气的目的是_______________________。
(3)装置B中导管D的作用是____________________,装置C中的溶液X为____________。
(4)步骤Ⅲ中加入稀硫酸酸化发生的反应为5Br-+BrO3-+6H+===3Br2+3H2O,每生成1 mol Br2单质,转移的电子数为________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】800℃时,三个相同的恒容密闭容器中发生反应CO(g) + H2O(g)![]() CO2(g) + H2(g) K,一段时间后,分别达到化学平衡状态。
CO2(g) + H2(g) K,一段时间后,分别达到化学平衡状态。
容器编号 | 起始浓度/(mol·L1) | |||
c(CO) | c(H2O) | c(CO2) | c(H2) | |
Ⅰ | 0.01 | 0.01 | 0 | 0 |
Ⅱ | 0 | 0 | 0.01 | 0.01 |
III | 0.008 | 0.008 | 0.002 | 0.002 |
下列说法不正确的是
A.Ⅱ 中达平衡时,c(H2)=0.005 mol·L1
B.III中达平衡时,CO的体积分数大于25%
C.III中达到平衡状态所需的时间比 Ⅰ 中的短
D.若III中起始浓度均增加一倍,平衡时c(H2)亦增加一倍
查看答案和解析>>
科目: 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g) ![]() H2(g)+I2(g)达到平衡时,c(H2)=1 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
H2(g)+I2(g)达到平衡时,c(H2)=1 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
A. 36 B. 24 C. 16 D. 9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com