
科目: 来源: 题型:
【题目】(1)在25℃、101kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100gCaCO3沉淀,则乙醇燃烧的热化学方程式为___。
(2)已知下列热化学方程式
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1= -25kJ·mol-1 ①
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2= -47kJ·mol-1 ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3= +19kJ·mol-1 ③写出FeO(s)被CO还原成Fe和CO2的热化学方程式____。
(3)向足量H2SO4溶液中加入100mL 0.4mol·L-1Ba(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4mol·L-1盐酸时,放出的热量为2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇水蒸气重整制氢方法是目前比较成熟的制氢方法,且具有良好的应用前景。甲醇水蒸气重整制氢的部分反应过程如图所示:
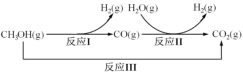
(1)已知一定条件下
反应I:CH3OH(g)=CO(g)+2H2(g) ΔH1=+90.7kJ/mol
反应III:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH3=+49.5kJ/mol
该条件下反应II的热化学方程式是___。
(2)已知反应II在进气比[n(CO):n(H2O)]不同时,在不同温度(T1、T2)下,测得相应的CO的平衡转化率见图。
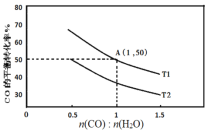
①比较T1、T2的大小,T1___T2(填“>”“<”或“=”)。
②A点对应的化学平衡常数是___。
③T1温度时,按下表数据开始反应建立平衡
CO | H2O | H2 | CO2 | |
起始浓度(mol/L) | 2 | 1 | 0 | 0 |
t时刻浓度(mol/L) | 1.2 | 0.2 | 0.8 | 0.8 |
反应进行到t时刻时,判断v(正)、v(逆)的大小关系为:v(正)___v(逆)(填“>”“<”或“=”)。
④当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是___。
(3)CO2在生产中有着广泛的用途。
①将过量CO2通入KOH溶液中可生成KHCO3,请写出该反应的离子方程式___。
②在经CO2饱和处理的KHCO3弱酸性溶液中,电解活化CO2可以制备乙醇,原理如图所示。该电极为___(填“阴极”或“阳极”),电极反应式是___。
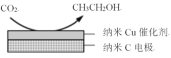
查看答案和解析>>
科目: 来源: 题型:
【题目】请用你所学的化学知识回答下列问题:
(1)Na、Mg、Al中第一电离能最大的是___(填元素符号),Fe原子基态电子排布式为___。
(2)下列反应可用于检测司机是否酒后驾驶:2Cr2O![]() +3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
①配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是___(填元素符号)。
②1molCH3COOH分子含有σ键的数目为___NA。
③H2O与CH3CH2OH可以任意比例互溶,除因为它们都是极性分子外,还因为___。
(3)S元素的最高价氧化物在气态时以单分子形式存在,中心原子的杂化方式为___杂化,其分子的立体构型为___。H2O、H2S、H2Se沸点由低到高的顺序___。
(4)将Cu的粉末加入浓氨水中,通入O2,充分反应后溶液呈深蓝色,该反应的离子方程式是___。
(5)金属元素X和非金属元素Y生成某化合物的晶胞如图(X用白球表示,Y用黑球表示),则该化合物的化学式为___。
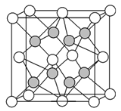
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是一种理想的绿色能源。
(1)在101KP下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题:
①氢气的燃烧热为________________
②该反应的热化学方程式为_____________________
(2)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:Mg(s)+H2(g)=MgH2(s)ΔH1=-74.5kJ·mol-1,Mg2Ni(s)+2H2(g)=Mg2NiH4(s)ΔH2,Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1,则ΔH2=____________kJ·mol-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】依据如图判断,下列说法正确的是( )
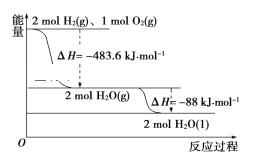
A. 氢气的燃烧热ΔH=-241.8 kJ·mol-1
B. 2 mol H2(g)与1mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低
C. 液态水分解的热化学方程式为2H2O(l)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:

(1)该图中有两处未画出,它们是______、__________。
(2)为什么所用NaOH溶液要稍过量_________________。
(3)倒入NaOH溶液的正确操作是_______________________。
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为______。
(5)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验 序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=______(结果保留一位小数)。
(6)____(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某简单(单核)粒子的原子核外有18个电子。
(1)若为原子,请画出其原子结构示意图_________。
(2)若为阳离子,请写出其常见的离子符号_______。
(3)若为阴离子,请写出其常见的离子符号_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在3个体积均为2.0 L的恒容密闭容器中,反应CO2(g)+C(s)![]() 2CO(g)ΔH>0,分别在一定温度下达到化学平衡状态。下列说法正确的是
2CO(g)ΔH>0,分别在一定温度下达到化学平衡状态。下列说法正确的是
容器 | 温度/K | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(CO2) | n(C) | n(CO) | n(CO) | ||
I | 977 | 0.28 | 0.56 | 0 | 0.4 |
II | 977 | 0.56 | 0.56 | 0 | x |
III | 1250 | 0 | 0 | 0.56 | y |
A.977K,该反应的化学平衡常数值为2
B.达到平衡时,向容器I中增加C的量,平衡正向移动
C.达到平衡时,容器Ⅰ中CO2的转化率比容器Ⅱ中的大
D.达到平衡时,容器Ⅲ中的CO的转化率大于28.6%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com