
科目: 来源: 题型:
【题目】工业炼铁的基本生产流程如图所示,请回答下列问题。
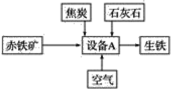
(1)写出设备A的名称:___________________________________________________。
(2)写出以赤铁矿为原料在高温下制取铁的化学方程式:__________________________。
(3)炼铁时焦炭的作用:
①________________________________________________________________________;
②________________________________________________________________________。
(4)石灰石的主要作用是造渣,造渣过程中涉及的主要反应有CaCO3![]() CaO+CO2↑、__________(写化学方程式)。
CaO+CO2↑、__________(写化学方程式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,对于可逆反应A(g)+2B(g)![]() 3C(g)的下列叙述中,能说明反应已达到平衡的是
3C(g)的下列叙述中,能说明反应已达到平衡的是
A.单位时间内消耗a mol A,同时生成3a mol CB.容器内的压强不再变化
C.![]() D.C的体积分数不再变化
D.C的体积分数不再变化
查看答案和解析>>
科目: 来源: 题型:
【题目】铁、铜及其化合物应用非常广泛。下列有关说法正确的是( )
A.地下钢管常用牺牲阳极的阴极保护法,阳极材料可用铜
B.反应Cu2S+O2![]() 2Cu+SO2,每生成1molCu转移电子数为6.02×1023
2Cu+SO2,每生成1molCu转移电子数为6.02×1023
C.反应2Cu+CO2+H2O+O2=Cu2(OH)2CO3室温下能自发进行,该反应的ΔH<0
D.室温下,Ksp[Fe(OH)3]=4×10-38,pH=4的含Fe3+溶液中,c(Fe3+)≤4×10-8mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.MgCl2(熔融)![]() Mg(s)
Mg(s)![]() MgO(s)
MgO(s)
B.CaC2(s)![]() C2H4(g)
C2H4(g)![]()
![]()
C.FeS2(s)![]() SO2(g)
SO2(g)![]() (NH4)2SO4(aq)
(NH4)2SO4(aq)
D.Al(OH)3(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() AlCl3(aq)
AlCl3(aq)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.Al与NaOH溶液反应:2Al+2OH-+2H2O=2AlO![]() +3H2↑
+3H2↑
B.Fe(OH)2与足量稀硝酸反应:Fe(OH)2+2H+=Fe2++2H2O
C.Na2S碱性溶液中通入SO2生成Na2S2O3:3SO2+S2-=2S2O![]()
D.KMnO4酸性溶液与SO2反应:2MnO![]() +5SO2+4OH-=2Mn2++5SO
+5SO2+4OH-=2Mn2++5SO![]() +2H2O
+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应CO(g)+H2O(g)![]() CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的△H也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
D. 若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.能使甲基橙变红的溶液中:Na+、Al3+、Br-、CH3COO-
B.![]() =1×10-12的溶液中:K+、Na+、CO
=1×10-12的溶液中:K+、Na+、CO![]() 、Cl-
、Cl-
C.0.1mol·L-1NaHSO3溶液中:Na+、NH![]() 、ClO-、MnO
、ClO-、MnO![]()
D.0.1mol·L-1Fe(NO3)3溶液中:Cu2+、Fe2+、SCN-、SO![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室从碘的四氯化碳溶液中分离并得到单质碘,主要步骤为:用浓NaOH溶液进行反萃取(3I2+6OH-=5I-+IO![]() +3H2O)、分液、酸化(5I-+IO
+3H2O)、分液、酸化(5I-+IO![]() +6H+=3I2↓+3H2O)、过滤及干燥等。下列有关实验原理和装置不能达到实验目的的是( )
+6H+=3I2↓+3H2O)、过滤及干燥等。下列有关实验原理和装置不能达到实验目的的是( )
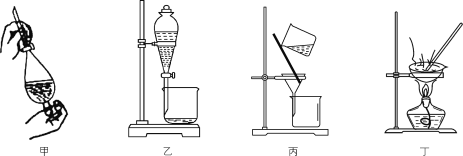
A.用装置甲反萃取时,倒转振荡过程中要适时旋开活塞放气
B.用装置乙分液时,先放出有机相,关闭活塞,从上口倒出水相
C.用装置丙从酸化后的体系中分离出单质碘
D.用装置丁干燥单质碘
查看答案和解析>>
科目: 来源: 题型:
【题目】一种利用H2C2O4(草酸)作助溶剂,酸浸提取硫酸烧渣(主要含Fe2O3、FeO、SiO2等)制备铁红并回收副产物硫酸铵的工艺流程如图:
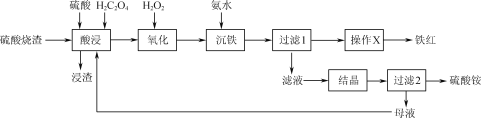
已知:H2C2O4可沉淀Ca2+、Fe2+等金属离子,可与Fe3+生成[Fe(C2O4)3]3-,在硫酸作用下可热分解生成CO和CO2。
(1)用50%的硫酸“酸浸”时,反应液的温度、H2C2O4的加入量对铁浸取率的影响分别如图1、图2所示:
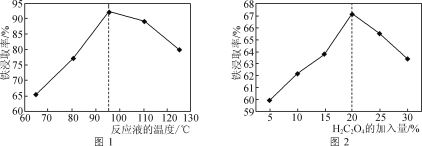
①“硫酸烧渣”中Fe2O3与H2SO4反应的化学方程式为___。
②图1中,反应液的温度高于95℃时,铁浸取率开始降低,其原因是___。
③图2中,H2C2O4加入量在5~20%时,铁浸取率随加入量的增大而增大,其原因是__;H2C2O4加入量超过20%时,铁浸取率反而开始降低,其原因是___。
(2)“沉铁”时发生的主要反应的离子方程式为____。
(3)由“过滤1”的滤渣制备铁红的“操作X”为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】18.4 g 氢氧化钠和碳酸氢钠固体混合物,在密闭容器中加热到250 ℃,经充分反应后排出气体,冷却,称得剩余固体质量为16.6 g。试计算原混合物中碳酸氢钠的质量分数。________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com