
科目: 来源: 题型:
【题目】一定条件下,在体积为3L的密闭容器中,发生反应:CO(g)+2H2(g)![]() CH3OH(g),在不同温度下甲醇的物质的量随时间的变化如图所示。下列叙述正确的是
CH3OH(g),在不同温度下甲醇的物质的量随时间的变化如图所示。下列叙述正确的是

A. 平衡常数K(300 ℃)<K(500 ℃)
B. 在其他条件不变时,压缩处于E点的体系体积,氢气浓度增大
C. 300 ℃,当容器内气体密度不变时说明反应已经达到平衡
D. 500 ℃,从反应开始到平衡,氢气的平均反应速率v(H2)=![]() mol·L1·min1
mol·L1·min1
查看答案和解析>>
科目: 来源: 题型:
【题目】在某一恒温、恒容的密闭容器中发生反应:3H2(g)+N2(g)![]() 2NH3(g) ΔH<0。t1时刻反应达到平衡,在t2时刻改变某一条件,其反应过程如图所示。下列说法正确的是
2NH3(g) ΔH<0。t1时刻反应达到平衡,在t2时刻改变某一条件,其反应过程如图所示。下列说法正确的是

A. Ⅰ、Ⅱ两过程达到平衡时,平衡常数:KⅠ<KⅡ
B. Ⅰ、Ⅱ两过程达到平衡时,NH3的体积分数:Ⅰ<Ⅱ
C. Ⅰ、Ⅱ两过程达到平衡的标志:气体的平均密度不再发生变化
D. t2时刻改变的条件可以是向密闭容器中加H2和N2的混合气
查看答案和解析>>
科目: 来源: 题型:
【题目】请按下列线条提示,画出Fe、Cu、S、H2、HCl、NaOH、H2SO4、Ba(OH)2、NaHCO3、K2O、CuO、NaCl 的树状分类图: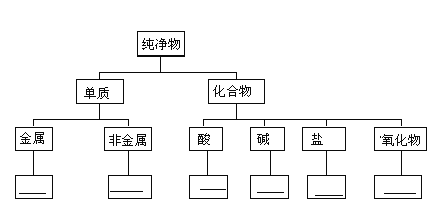
_____ _____ ____ ___ __ ___
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学研究性学习小组的同学根据理论分析后认为,NO2可能会氧化单质铜,他们设想利用下图所示装置验证NO2的氧化性(夹持装置已省略)。
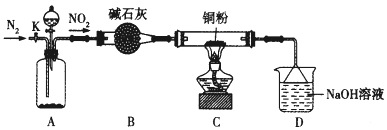
(1)装置A~C中有一处错误,改正的方法是_____________,A中发生反应的两种试剂通常是________。
(2)点燃C处酒精灯比较合适的时机是_____________。若C中固体全部变成黑色,同时生成对环境无污染的气体,写出C中反应的化学方程式:______________。装置D的用途是____________。
(3)开关K的设计是以实现绿色化学实验为目的,请说明K的使用方法______________。(包括使用时段与内容)。
(4)实验结束后发现C中的固体混有少量的红色粉末,经过分析,甲同学认为该红色粉末是Cu2O,乙同学认为该红色粉末是![]() ,丙同学认为该红色粉末是Cu和Cu2O的混合物。查阅资料,Cu、Cu2O和CuO的部分性质如下:
,丙同学认为该红色粉末是Cu和Cu2O的混合物。查阅资料,Cu、Cu2O和CuO的部分性质如下:
稀硫酸 | 氨水 | |
Cu2O | 生成Cu和Cu2+ | 生成无色[Cu(NH3)2]2+ |
CuO | 生成Cu2+ | 生成蓝色[Cu(NH3)4]2+ |
Cu | --- | --- |
请设计一个简单的实验证明甲同学的看法是否正确:________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年8月13日中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2 [Sn(OH)6][B(OH)4] 2并获得了该化合物的LED器件,该研究结果有望为白光发射的设计和应用提供一个新的有效策略。
(1)基态Sn原子价层电子的空间运动状态有___种,基态氧原子的价层电子排布式不能表示为![]() ,因为这违背了____原理(规则)。
,因为这违背了____原理(规则)。
(2)[B(OH)4] -中氧原子的杂化轨道类型为____,[B(OH)4] -的空间构型为______。 [Sn(OH)6] 2-中,Sn与O之间的化学键不可能是___。
a ![]() 键 b σ键 c 配位键 d 极性键
键 b σ键 c 配位键 d 极性键
(3)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是_____(填化学式),其原因是___________。
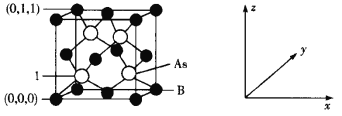
(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如下图所示,则1号砷原子的坐标为____。已知阿伏加德罗常数的值为NA,若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为__g·cm-3(列出含a、NA的计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)2012年伦敦奥运会火炬采用丙烷为燃料。丙烷热值较高,污染较小,是一种优良的燃料。试回答下列问题:

①如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,请在图中的括号内填入“+”或“-”。
②写出表示丙烷燃烧热的热化学方程式:___________________________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1 455 kJ热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645 kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为________。
(2)盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①已知:H2O(g)=H2O(l) ΔH1=-Q1 kJ/mol C2H5OH(g)=C2H5OH(l) ΔH=-Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-Q3 kJ/mol
若使46 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为________kJ。
②碳(s)在氧气供应不充足时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应: C(s)+![]() O2(g)=CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。
O2(g)=CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳、氮能形成多种氧化物、氢化物。
(1)已知:①![]()
②![]()
则![]() 与
与![]() 反应生成两种无毒气体的热化学方程式为_____________。
反应生成两种无毒气体的热化学方程式为_____________。
(2)使用高效催化剂可大大减少汽车尾气排放出的![]() 含量,某研究所的科研人员探究了
含量,某研究所的科研人员探究了![]() 时等质量的三种催化剂对
时等质量的三种催化剂对![]() 还原
还原![]() 的催化效果(其他条件相同),所得结果如图所示:
的催化效果(其他条件相同),所得结果如图所示:
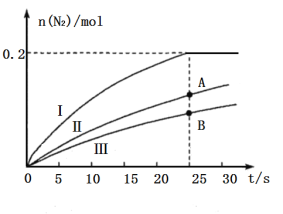
①如果不考虑催化剂价格,则使用催化剂______(填“Ⅰ”“Ⅱ”或“Ⅲ”)最好;A、B两状态下,生成![]() 的速率大小关系是___________。
的速率大小关系是___________。
②若容器容积为2L,开始时加入![]() 、
、![]() ,在催化剂Ⅰ的作用下达到如图所示平衡,则反应
,在催化剂Ⅰ的作用下达到如图所示平衡,则反应![]() 在该温度下的平衡常数
在该温度下的平衡常数![]() ______
______![]() 。
。
③在如图坐标系中画出使用催化剂Ⅰ(其他条件相同)时,25s时容器内反应的脱氮率(![]() 转化率)与温度的关系图___________。
转化率)与温度的关系图___________。
(3)化学动力学上将一步完成的反应称为基元反应。对于基元反应:![]() ,其速率方程式为
,其速率方程式为![]() (k为只与温度有关的速率常数),复杂反应(由几个基元反应构成)的速率取决于慢的基元反应。
(k为只与温度有关的速率常数),复杂反应(由几个基元反应构成)的速率取决于慢的基元反应。
①已知反应![]() ,在温度低于
,在温度低于![]() 时是由两个基元反应构成的复杂反应,该反应的速率方程式为
时是由两个基元反应构成的复杂反应,该反应的速率方程式为![]() ,则其两个基元反应分别为:Ⅰ.______
,则其两个基元反应分别为:Ⅰ.______![]() ______;Ⅱ.略,这两个反应中活化能较小的是__________。
______;Ⅱ.略,这两个反应中活化能较小的是__________。
②某科研小组测得![]() 时该反应的
时该反应的![]() 、
、![]() 生成
生成![]() 的速率
的速率![]() 的关系如下:
的关系如下:
| 0.025 | 0.05 | 0.025 |
| 0.04 | 0.04 | 0.12 |
|
|
|
|
则该温度下的反应速率常数![]() ______
______![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,Ksp(CaCO3)=2.8×10-9,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断错误的是

A.a点是CaSO4的饱和溶液而b点不是
B.蒸发水可使溶液由b点变化到a点
C.常温下,CaCO3(s)+![]() (aq)
(aq)![]() CaSO4(s)+
CaSO4(s)+![]() (aq)的K=3.1×10-4
(aq)的K=3.1×10-4
D.除去锅炉中的CaSO4时,可用Na2CO3溶液将其转化为CaCO3
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1 NaOH溶液,实验尚缺少的玻璃用品是___________、___________。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒___________(填“能”或“否”),其
原因是 。
(3)他们记录的实验数据如下:

已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
①计算完成上表ΔH=_____________。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(4)若用KOH代替NaOH,对测定结果__________(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果____________(填“有”或“无”)影响。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在体积为10L的密闭容器中充入1mol X和1mol Y进行反应:2X(g)+Y(g)![]() Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
A.X的平衡转化率为40%
B.若将容器体积变为20L,则Z的平衡浓度小于原来的![]()
C.若增大压强,则Y的平衡转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com