
科目: 来源: 题型:
【题目】已知反应![]() 是可逆反应。设计如图装置(
是可逆反应。设计如图装置(![]() 均为石墨电极),分别进行下述操作:
均为石墨电极),分别进行下述操作:
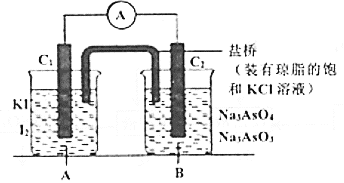
①向B烧杯中逐滴加入浓盐酸。②向B烧杯中逐滴加入![]() 溶液。结果发现电流表指针均发生偏转。
溶液。结果发现电流表指针均发生偏转。
(1)①过程中![]() 棒上发生的反应为_________;
棒上发生的反应为_________;
②过程中![]() 棒上发生的反应为___________。
棒上发生的反应为___________。
(2)操作②过程中,盐桥中的![]() 移向_________烧杯溶液(填“A”或“B”)。
移向_________烧杯溶液(填“A”或“B”)。
资料:![]() 。向
。向![]() 一定浓度的
一定浓度的![]() 溶液中加入
溶液中加入![]() 溶液,达平衡后,相关微粒浓度如下:
溶液,达平衡后,相关微粒浓度如下:
微粒 |
|
|
|
浓度 |
|
| a |
(3)a=________________。该平衡体系中除了含有![]() 和
和![]() 外,判断溶液是否一定还含有其他含碘微粒______________(填“是”或“否”)。
外,判断溶液是否一定还含有其他含碘微粒______________(填“是”或“否”)。
(4)已知:甲醇与水蒸气重整制氢可直接用于燃料电池。
反应:![]()
反应:![]()
则![]() ______________
______________![]()
(5)已知:25℃时,![]() 。医学上进行消化系统的X射线透视时,常使用
。医学上进行消化系统的X射线透视时,常使用![]() 作内服造影剂。胃酸酸性很强(pH约为1),但服用大量
作内服造影剂。胃酸酸性很强(pH约为1),但服用大量![]() 仍然是安全的,
仍然是安全的,![]() 不溶于酸的原因是(用溶解平衡原理解释):_________。误服少量
不溶于酸的原因是(用溶解平衡原理解释):_________。误服少量![]() ,应尽快用大量的一定浓度的
,应尽快用大量的一定浓度的![]() 溶液给患者洗胃,忽略洗胃过程中
溶液给患者洗胃,忽略洗胃过程中![]() 溶液浓度的变化,要使残留在胃液中的
溶液浓度的变化,要使残留在胃液中的![]() 浓度为
浓度为![]() ,应服用的
,应服用的![]() 溶液的最低浓度为_______
溶液的最低浓度为_______![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列方法中可以证明 2HI(g) ![]() H2(g)+I2(g)已达平衡状态的是_________。
H2(g)+I2(g)已达平衡状态的是_________。
①单位时间内生成 n mol H2 的同时生成 n mol HI;
②一个 H—H 键断裂的同时有一个 H—I键断裂;
③百分组成ω(HI)=ω(I2);
④反应速率v(H2)=v(I2)= ![]() v(HI)时;
v(HI)时;
⑤c(HI):c(H2):c(I2)=2:1:1 时;
⑥温度和体积一定时,某一生成物浓度不再变化;
⑦温度和体积一定时,容器内压强不再变化;
⑧条件一定,混合气体的平均相对分子质量不再变化;
⑨温度和体积一定时,混合气体的颜色不再变化;
⑩温度和压强一定时,混合气体的密度不再变化;
(2)对于合成氨上述能说明达到平衡状态的是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】芯片主要由单晶体硅成。下图是硅及其化合物的类价二维图,根据要求完成下列化学方程式或离子方程式。
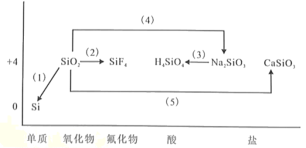
(1)利用焦炭在电炉中还原二氧化硅的化学方程式为_______________。
(2)利用氢氟酸刻蚀玻璃的化学方程式为_______________。
(3)硅酸钠转化为原硅酸的离子方程式_______________。
(4)二氧化硅与烧碱溶液反应的化学方程式_______________。
(5)石英与纯碱在玻璃熔炉里加强热发生反应的化学方程式为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,用等浓度的NaOH溶液,分别滴定浓度均为0.1 mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是( )
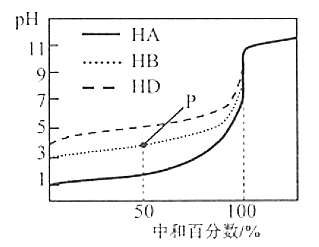
A.等浓度的三种酸中和等量的NaOH需要三种酸的体积:V(HA)>V(HB)>V(HD)
B.从滴定开始至pH=7时,三种溶液中水的电离程度逐渐增大
C.滴定至P点时,溶液中:c(HB)+c(H+)=c(B-)+c(OH-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列关于铜生锈反应2Cu+O2+H2O+CO2=Cu2(OH)2CO3的说法错误的是
A.消耗32gCu转移的电子数为NAB.1.8g H2O含有的质子数为NA
C.22g CO2的共用电子对数为NAD.标况下,11.2LO2和CO2混合气体中O原子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】煤炭燃烧发电副产物可用于提取高纯度氧化铝,其工艺流程如下:
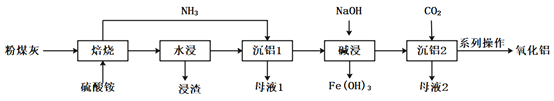
已知:粉煤灰的主要成份是Al2O3,主要杂质是SiO2、Fe2O3。
“焙烧”的主要反应:Fe2O3+4(NH4)2SO4=2NH4Fe(SO4)2+6NH3↑+3H2O Al2O3+4(NH4)2SO4=2NH4Al(SO4)2+6NH3↑+3H2O 回答下列问题:
(1)“浸渣”的主要成分为________(填化学式)。
(2)“沉铝1”中生成含铝元素沉淀的离子方程式是________。
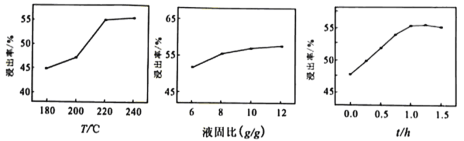
(3)结合下图分析“碱浸”时最优条件是________(填序号)。
A、200℃、8g/g、1.0h B、200℃、10g/g、1.5h C、220℃、10g/g、1.0h D、220℃、12g/g、1.5h
(4) “沉铝2”发生反应的离子方程式为________。
(5)流程中“一系列操作”是________。
(6)流程中可循环利用的物质是________。(填化学式)
(7)用1t含铝10.8%的粉煤灰,制得高纯度Al2O3 80kg,其产率为________%(结果保留1位小数)。
(8)传统工艺流程中第一步是将粉煤灰用硫酸“酸浸”脱硅,与之相比硫酸铵法的优点是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知2A(g)+B(g) ![]() 2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
(1)比较a___b(填“>”“=”或“<”)。
(2)下表为不同温度下该反应的平衡常数。由此可推知,表中T1____T2(填“>” “=”或“<”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2molC,500℃时充分反应达平衡后,吸收热量为c kJ,C的浓度___(填“>”、“=”或“<”)ωmol/L,a、b、c之间满足何种关系_______(用代数式表示)。
(3)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是_____。
A.4molA和2molB B.4molA、2molB和2molC C.4molA和4molB D.6molA和4molB
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是____。
A.及时分离出C气体 B.适当升高温度 C.增大B的浓度 D.选择高效催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA和1molB,500℃时充分反应达平衡后,放出热量为d kJ,则d_____b(填“>”“=”或“<”),理由是_________。
(6)在一定温度下,向一个容积可变的容器中,加入3molA和2molB及固体催化剂,使之反应:2A(g)+B(g)![]() 2C(g),平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量_____(填“不变”“变大”“变小”或“无法确定”)。
2C(g),平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量_____(填“不变”“变大”“变小”或“无法确定”)。
查看答案和解析>>
科目: 来源: 题型:
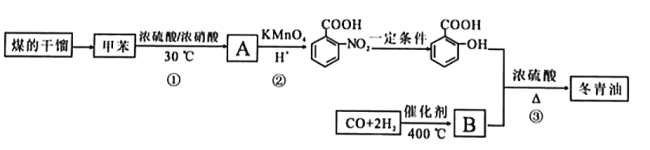
【题目】甲苯是煤干馏的产物,可用于制备具有止痛退热效果的冬青油( 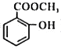 ),合成路线如下:
),合成路线如下:
已知: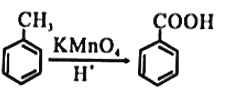
请回答下列问题
(1)煤的干馏是_______________。(填“物理变化”或“化学变化”).
(2)A的结构简式为_______________。反应①的反应类型是_______________。
(3)反应②的反应类型是_______________。
(4)B的官能团名称为_______________。
(5)反应③的化学方程式_______________。
(6)C是冬青油的同分异构体,其苯环上的取代基与冬青油相同,则C的结构简式可能为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,离子方程式为:Fe3++3SCN-
Fe(SCN)3+3KCl,离子方程式为:Fe3++3SCN-![]() Fe(SCN)3,达到平衡后,进行下列操作,平衡怎样移动?
Fe(SCN)3,达到平衡后,进行下列操作,平衡怎样移动?
(1)加入少量FeCl3固体:平衡向____________移动;
(2)加入少量KSCN固体:平衡向____________移动;
(3)加入少量KCl固体:平衡____________移动,其理由是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用98%的浓硫酸(ρ=1.84 g·mL-1)配制1∶5的稀硫酸(ρ=1.19 g·mL-1)。
(1)浓硫酸的物质的量浓度是________。
(2)稀硫酸的物质的量浓度是________。
(3)稀硫酸的质量分数是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com