
【题目】已知NA是阿伏加德罗常数的值,下列关于铜生锈反应2Cu+O2+H2O+CO2=Cu2(OH)2CO3的说法错误的是
A.消耗32gCu转移的电子数为NAB.1.8g H2O含有的质子数为NA
C.22g CO2的共用电子对数为NAD.标况下,11.2LO2和CO2混合气体中O原子数为NA
【答案】C
【解析】
A. 32gCu的物质的量为:![]() =0.5mol,消耗0.5molCu转移电子的物质的量为:0.5mol×2=1mol,转移的电子数为NA,故A正确;
=0.5mol,消耗0.5molCu转移电子的物质的量为:0.5mol×2=1mol,转移的电子数为NA,故A正确;
B. 1.8g水的物质的量为:![]() =0.1mol,含有质子的物质的量为:0.1mol×10=1mol,含有的质子数为NA,故B正确;
=0.1mol,含有质子的物质的量为:0.1mol×10=1mol,含有的质子数为NA,故B正确;
C. 22gCO2的物质的量为:![]() =0.5mol,含有共用电子对的物质的量为:0.5mol×4=2mol,共用电子对数为2NA,故C错误;
=0.5mol,含有共用电子对的物质的量为:0.5mol×4=2mol,共用电子对数为2NA,故C错误;
D. 标况下11.2L O2和CO2的物质的量为:![]() =0.5mol,含有O的物质的量为:0.5mol×2=1mol,含有O原子数为NA,故D正确;
=0.5mol,含有O的物质的量为:0.5mol×2=1mol,含有O原子数为NA,故D正确;
答案选C。


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】测定0.1mol·L-1Na2SO3溶液先升温再降温过程中的pH,数据如下表。实验过程中,取①、④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。下列说法不正确的是( )
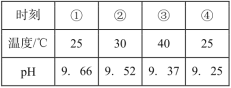
A.Na2SO3溶液中存在水解平衡:SO32-+H2O![]() HSO3-+OH-
HSO3-+OH-
B.④产生的白色沉淀是BaSO4
C.①→③的过程中,c(SO32-)在降低
D.①→③的过程中,温度与c(SO32-)相比,前者对水解平衡的影响更大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出___(填外部因素)的改变对化学反应速率的影响,其中V1=____、T1=____;通过实验___(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=____。
(2)若t1<8,则由此实验可以得出的结论是_____;忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=___。
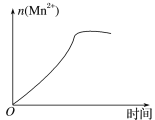
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊作用,则该作用是____,相应的粒子最可能是___(填粒子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略)。首先在U形管内加入少量煤油和几粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一段时间后加热铜丝。
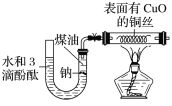
根据反应中观察到的现象,回答下列问题:
(1)金属钠的变化现象________。
(2)U形管中溶液的颜色_____,说明有__________生成。
(3)铜丝的变化现象____________,说明有________生成;若去掉后面的装置,简述检验气体的方法____
(4)若a g钠与b mL水完全反应,则该溶液溶质的质量分数是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(ρ=1.84 g·mL-1)配制1∶5的稀硫酸(ρ=1.19 g·mL-1)。
(1)浓硫酸的物质的量浓度是________。
(2)稀硫酸的物质的量浓度是________。
(3)稀硫酸的质量分数是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molSO2和2molO2的混合气体置于体积可变的恒压容器中,在一定条件下发生如下反应2SO2(g)+ O2(g)![]() 2SO3(g) ΔH<0,该反应达平衡时,测得气体总物质的量为4.2mol,试回答:
2SO3(g) ΔH<0,该反应达平衡时,测得气体总物质的量为4.2mol,试回答:
(1)在该平衡时,n(SO3)=_____mol
(2)若起始时加入1.2molSO2、0.6molO2和xmolSO3,达到平衡时各气体体积分数与上述平衡状态相同,则x的取值范围是________
(3)若反应开始时v(逆)> v(正),达到上述平衡状态时,气体的总物质的量仍为4.2mol,则起始时n(SO3)的取值范围是______
(4)若反应过程中SO2、O2、SO3物质的量变化如图所示。则反应进行至20min时,曲线发生变化的原因是______________________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。

A.加了催化剂 | B.缩小容器体积 |
C.降低温度 | D.增加SO3的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①1mol晶体硅中含有2molSi—Si键。
②Si(s)+O2(g)===SiO2(g) ΔH,其反应过程与能量变化如图所示。
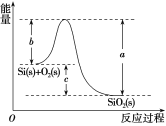
③
化学键 | Si—O | O=O | Si—Si |
断开1 mol共价键所需能量/kJ | 460 | 500 | 176 |
下列说法中正确的是( )
A.晶体硅光伏发电是将化学能转化为电能B.二氧化硅稳定性小于硅的稳定性
C.ΔH=-988kJ·mol-1D.ΔH=(a-c)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素![]() 的原子序数依次增大,W原子的最外层电子数等于Y原子最外层电子数的2倍;四种元素形成的一种化合物的结构如图所示,该化合物的阴离子中每个原子的最外层均满足8电子稳定结构,下列说法错误的是( )
的原子序数依次增大,W原子的最外层电子数等于Y原子最外层电子数的2倍;四种元素形成的一种化合物的结构如图所示,该化合物的阴离子中每个原子的最外层均满足8电子稳定结构,下列说法错误的是( )

A.原子半径:![]() B.W与Z形成晶体的基本单元为平面结构
B.W与Z形成晶体的基本单元为平面结构
C.X与Z在自然界中均不存在游离态D.W与Y形成的化合物可作耐火材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列叙述正确的是( )
为阿伏加德罗常数的值。下列叙述正确的是( )
A.已知![]() ;
;![]() 将2NA个CO与NA个O2混合充分反应放出akJ的热量
将2NA个CO与NA个O2混合充分反应放出akJ的热量
B.t℃时,1LpH=6的纯水中含OHˉ数为10-6NA
C.标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA
D.1L0.1mol/L的氢碘酸中含碘化氢分子数为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com