
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出___(填外部因素)的改变对化学反应速率的影响,其中V1=____、T1=____;通过实验___(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=____。
(2)若t1<8,则由此实验可以得出的结论是_____;忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=___。
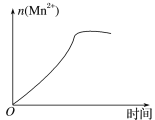
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊作用,则该作用是____,相应的粒子最可能是___(填粒子符号)。
【答案】浓度 1 293 B、C 3 其他条件相同时,增大反应物浓度,反应速率增大 8.3×10-4mol·L-1·s-1 催化作用 Mn2+
【解析】
(1)A、B应控制温度相同,探究浓度对反应速率的影响,B、C温度不同可探究温度对反应速率的影响,研究某种因素对反应速率的影响时,需要保证气体条件相同,据此分析解答;
(2)若t1<8,则浓度越大,反应速率越大;结合v=![]() 计算;
计算;
(3)根据n(Mn2+)随时间的变化情况的图像,反应生成的锰离子可作催化剂加快反应速率。
(1)实验A、B,滴加H2C2O4溶液的体积不等,故实验A、B,可探究出H2C2O4浓度的改变对反应速率的影响;据实验A可知,保证溶液的总体积为6mL,B中H2C2O4溶液3mL,故需加水6mL-2mL-3mL=1mL;A、B研究浓度对化学反应速率的影响,需要温度相同,故T1=293;B、C温度不同,要探究出温度变化对化学反应速率的影响,其余条件相同,则V2=6mL-2mL-1mL=3mL;
(2)若t1<8,则由此实验可以得出的结论是其他条件相同时,增大反应物浓度,反应速率增大;根据实验B中数据可知,高锰酸钾完全反应需要的时间为8s,高锰酸钾的物质的量为0.02molL-1×0.002L=0.00004mol,混合后溶液中高锰酸钾的浓度为![]() =
=![]() ×10-3mol/L,则用KMnO4的浓度变化表示的反应速率为
×10-3mol/L,则用KMnO4的浓度变化表示的反应速率为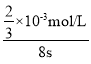 =8.3×10-4mol/(L·s);
=8.3×10-4mol/(L·s);
(3)根据n(Mn2+)随时间的变化情况的图像,反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是催化作用,相应的粒子最有可能的是Mn2+。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】2020年5月1日北京市在全市范围内开展施行垃圾分类,下列垃圾分类不正确是( )
A.鱼骨、菜叶 | B.消毒剂及其包装物 | C.破损的易拉罐 | D.破碎玻璃 |
|
|
|
|
厨余垃圾 | 有害垃圾 | 可回收垃圾 | 其他垃圾 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照下图所示的操作步骤,完成氢氧化钠与盐酸的反应的实验。
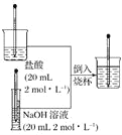
回答下列问题:
(1)反应后混合溶液的温度与反应前盐酸和氢氧化钠溶液的温度相比较其变化是___________________________________。
(2)你认为酸碱中和反应是放热反应还是吸热反应____________________________________。
(3)写出该反应的离子方程式:____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2012年伦敦奥运会火炬采用丙烷为燃料。丙烷热值较高,污染较小,是一种优良的燃料。试回答下列问题:

①如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,请在图中的括号内填入“+”或“-”。
②写出表示丙烷燃烧热的热化学方程式:___________________________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1 455 kJ热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645 kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为________。
(2)盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①已知:H2O(g)=H2O(l) ΔH1=-Q1 kJ/mol C2H5OH(g)=C2H5OH(l) ΔH=-Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-Q3 kJ/mol
若使46 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为________kJ。
②碳(s)在氧气供应不充足时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应: C(s)+![]() O2(g)=CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。
O2(g)=CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,X、Y、Z在一个容积为2L的密闭容器中反应,这三种物质的物质的量随时间的变化曲线如图所示。
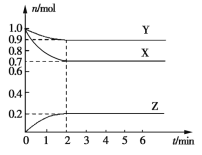
根据图中数据回答下列问题:
(1)该反应的化学方程式为____。
(2)在前2min内,气体Z的化学反应速率为___。
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的___倍;
②若此时将容器的容积减小为原来的![]() ,再次达到平衡时,容器内温度升高(容器不与外界进行热交换),则该反应的正反应为____(填“放热”或“吸热”)反应。
,再次达到平衡时,容器内温度升高(容器不与外界进行热交换),则该反应的正反应为____(填“放热”或“吸热”)反应。
(4)若上述反应在第2min后的t1~t6内反应速率与反应时间的关系如下,在每一时刻均只改变一个条件,则____。
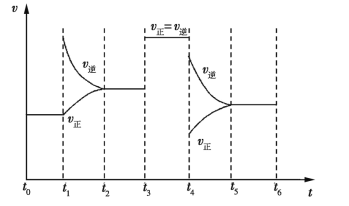
A.在t1时增大了压强 B.在t3时加入了催化剂
C.在t4时降低了温度 D.在t2~t3时X的转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下22% 硝酸钠溶液150 mL,加入100 g水稀释后溶质质量分数变为14%。
(1)原硝酸钠溶液的质量是__________。
(2)原硝酸钠溶液的物质的量浓度是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度不变、恒容的容器中进行反应2HI![]() H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L,需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为( )
H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L,需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为( )
A.等于10 sB.等于12 sC.大于12 sD.小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列关于铜生锈反应2Cu+O2+H2O+CO2=Cu2(OH)2CO3的说法错误的是
A.消耗32gCu转移的电子数为NAB.1.8g H2O含有的质子数为NA
C.22g CO2的共用电子对数为NAD.标况下,11.2LO2和CO2混合气体中O原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。
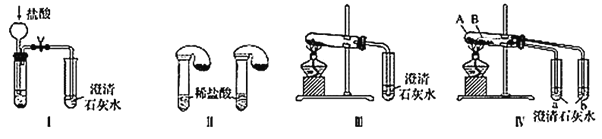
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是________(填装置序号)。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为__________;与实验Ⅲ相比,实验Ⅳ的优点是_____(填字母)。
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ比Ⅲ操作简便
D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是________(填化学式),实验过程中的现象为__________。
(4)除了以上方法,请你再举出一例鉴别二者的方法:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com