
科目: 来源: 题型:
【题目】某实验小组用0.50mol·L-1 NaOH溶液和0.50mol·L-1硫酸溶液进行反应热的测定。
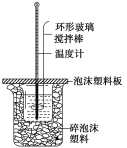
(1)写出该反应的热化学方程式[生成1 molH2O(l)时的反应热为-57.3 kJ·mol-1]:___。
(2)取50 mLNaOH溶液和30 mL 硫酸溶液进行实验,实验数据如表。
①请填写表中的空白:
温度 次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ___ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸溶液的密度都是1.0g·mL-1,中和后生成溶液的比热容c=4.18J/(g·℃)。则生成1 mol H2O(l)时的反应热ΔH=___(取小数点后一位)。
③上述实验数值结果与-57.3kJ·mol-1有偏差,产生偏差的原因不可能是(填字母)___。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目: 来源: 题型:
【题目】氯乙酸(CH2ClCOOH)是重要的分析试剂和有机合成中间体。一种制备氯乙酸的方法为CH3COOH+Cl2 ![]() CH2ClCOOH+HCl,已知:PCl3易水解。学习小组用如图所示装置进行探究,下列说法正确的是( )
CH2ClCOOH+HCl,已知:PCl3易水解。学习小组用如图所示装置进行探究,下列说法正确的是( )
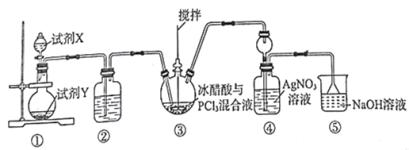
A.试剂X、Y依次选用浓盐酸、MnO2
B.②的作用为除去Cl2中的HCl
C.③中反应后的液体经蒸馏可得氯乙酸
D.④中出现白色沉淀说明有HCl生成
查看答案和解析>>
科目: 来源: 题型:
【题目】已知镁能在O2、N2、CO2中燃烧生成相应的化合物。试回答:
(1)镁在空气中燃烧,除发生反应N2+3Mg![]() Mg3N2外,还能发生其他反应,写出反应的化学方程式:____________。
Mg3N2外,还能发生其他反应,写出反应的化学方程式:____________。
(2)镁条在氧气中燃烧时看到的现象是________。
(3)如果等质量的镁分别在足量的氧气、氮气、二氧化碳中燃烧,燃烧后固体的质量分别为m1、m2、m3,则它们的大小顺序为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及其化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:

ΔH=88.6 kJ/mol则M、N相比,较稳定的是________。
(2)已知CH3OH(l)的燃烧热为-726.5 kJ·mol-1,CH3OH(l)+1/2O2(g)===CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a________726.5(填“>”“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:_______________________________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料:4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】锌空气燃料电池广泛用于铁路、航海灯标以及助听器中,其装置示意图如图所示。下列说法错误的是( )
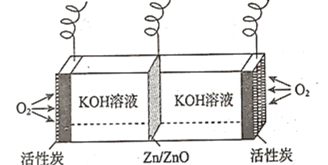
A.放电时,负极的电极反应式为![]()
B.放电时,![]() 向活性炭电极方向移动
向活性炭电极方向移动
C.充电时,![]() 电极上的电势比活性炭电极上的高
电极上的电势比活性炭电极上的高
D.充电时阴极质量减小![]() ,理论上阳极生成
,理论上阳极生成![]() 气体
气体
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素![]() 的原子序数依次增大,W原子的最外层电子数等于Y原子最外层电子数的2倍;四种元素形成的一种化合物的结构如图所示,该化合物的阴离子中每个原子的最外层均满足8电子稳定结构,下列说法错误的是( )
的原子序数依次增大,W原子的最外层电子数等于Y原子最外层电子数的2倍;四种元素形成的一种化合物的结构如图所示,该化合物的阴离子中每个原子的最外层均满足8电子稳定结构,下列说法错误的是( )

A.原子半径:![]() B.W与Z形成晶体的基本单元为平面结构
B.W与Z形成晶体的基本单元为平面结构
C.X与Z在自然界中均不存在游离态D.W与Y形成的化合物可作耐火材料
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )
A.海水中含有钠元素,只需经过物理变化就可以得到金属钠
B.海水蒸发制得粗盐,经提纯后再电解盐溶液可以得到金属钠
C.从海水中提纯到的食盐,电解饱和食盐水产生的产物可以制得“84”消毒液(NaClO)
D.可以通过物理方法直接从海水中提取溴单质
查看答案和解析>>
科目: 来源: 题型:
【题目】有人提出可以利用海水(含NaCl)和石灰石为原料制取漂白粉,该方法流程如下:
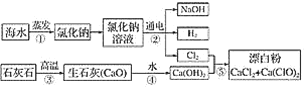
(1)②中的反应物是氯化钠和________,该反应的离子程式为_________。
(2)写出反应④、⑤的化学方程式:_________。
(3)图中反应②③④⑤属于氧化还原反应的是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组制备一定量的乙酸乙酯.取3mL无水乙醇,2mL浓硫酸,2mL冰醋酸进行实验,用5mL饱和碳酸钠溶液收集产物。
I.实验装置如图所示
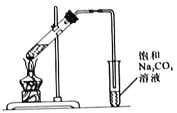
(1)制备乙酸乙酯的化学方程式为_______________。
(2)浓硫酸的作用是_______________。
(3)长导管的作用是_______________。
(4)接收装置还可选择下图中的___________。(填序号).
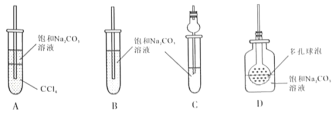
Ⅱ.甲同学用含有酚酞的饱和碳酸钠溶液(呈碱性)收集产物后振荡,发现红色迅速退去.
甲同学认为是蒸出的乙酸中和了碳酸钠.乙同学通过查阅资料并进行如下实验,证明甲同学的推测是错误的。
已知:酚酞难溶于水,易溶于有机溶剂;酚酞试剂是酚酞的乙醇溶液.
实验i,取振荡后的下层无色液体,分成两份,分别完成以下实验
序号 | 实验操作 | 实验现象 | 结论 |
1 | 滴加几滴酸酞试剂 | 溶液 ① (填“变红”成“不变红”) | 碳酸钠并未被乙酸完全中和,仍有大量剩余 |
2 | 滴入乙酸溶液 | 有大量气泡产生 |
实验ii.取振荡后的上层液体,加入 ② 溶液,振荡,发现出现浅红色,静置分层后红色消失。
实验iii,取5mL饱和碳酸钠溶液,滴入几滴酚酞试剂,再加入3mL乙酸乙酯(不含乙酸)振荡,溶液先变红,振荡后红色消失。回答下列问题
(5)完成上述实验:①_______________。②_______________。
(6)结合实验ii和实验iii的现象,可得出的结论是_______________。
(7)实验iii的实验目的是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】把温度为20 ℃,浓度为1.0 mol/L的H2SO4溶液和2.2 mol/L的碱溶液各50 mL混合[溶液密度均为1g/mL,比热容为4.18 kJ/(kg·℃)]轻轻搅动,测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1 ℃ | 终止温度t2 ℃ |
H2SO4+NaOH | 20 | 33.6 |
H2SO4+NH3·H2O | 20 | 32.6 |
(1)反应NH3·H2O(aq)![]() NH4+ (aq)+OH-(aq)的焓变约____。
NH4+ (aq)+OH-(aq)的焓变约____。
(2)计算上述两组实验测出的中和热:ΔH1=___kJ/mol;ΔH2=__kJ/mol。
(3)由本题结论可预测将第1组中的1 mol/L的H2SO4溶液换成2mol/L的CH3COOH溶液进行实验,测得的中和热数值__(填“大于”“小于”或“等于”)56.848。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com