
科目: 来源: 题型:
【题目】中山大学化学科研团队首次将CsPbBr3纳米晶锚定在氨基化RGO包覆的α—Fe2O3(α—Fe2O3/Amine—RGO/CsPbBr3),构筑Z—Scheme异质结光催化剂,可有效降低电荷复合,促进电荷分离,从而提升光催化性能。光催化还原CO2和氧化H2O的反应路径如图。下列说法正确的是( )
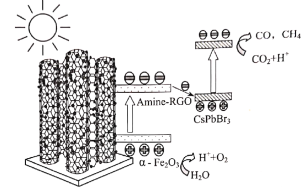
A.该路径能量转化形式为电能→化学能
B.该光催化转化反应可以阻止温室效应
C.“CsPbBr3纳米晶”表面发生了还原反应
D.该催化转化的总反应涉及到非极性共价键、极性共价键的断裂和形成
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生产、生活密切相关。下列说法错误的是( )
A.食用油和白酒都应密封保存
B.高温下铝粉和氧化铁的反应可以用来焊接铁轨
C.电影放映时射到银幕上的光柱证明存在气溶胶
D.钢铁锈蚀、食物腐败、钟乳石的形成均涉及氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生为比较镁、铝的金属性强弱,设计了如下实验:
(1)向两支试管中分别加入3 mL同浓度的稀盐酸,再将两块大小相同且纯净的镁片和铝片分别加入试管中,反应初始时观察到如图所示的现象,则试管b内加入的金属为____________(写化学式)。
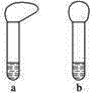
(2)若加入的两块金属的物质的量相等,且试管中稀盐酸足量,充分反应后,气球状态也如上图所示,则试管b中反应的离子方程式为___________。
(3)分析判断,实验________[填“(1)”或“(2)”]能证明镁的金属性强于铝。
查看答案和解析>>
科目: 来源: 题型:
【题目】粉煤灰是燃煤产生的重要污染物,主要成分有Al2O3、Fe2O3、MgO和SiO2等物质。用硫酸铵固体等试剂提取粉煤灰中Al2O3并制取铝的工艺流程如图:
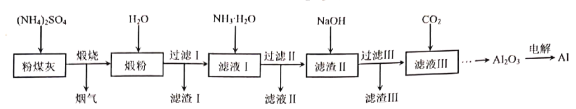
回答下列问题:
(1)已知烟气中含有NH3,煅烧工序中Al2O3参与反应的化学方程式为___。
(2)“滤渣Ⅰ”和“滤渣Ⅲ”主要成分的化学式分别为__、__。
(3)将“滤液Ⅱ”通过__、过滤、洗涤、干燥后得到的晶体可返回__工序中循环利用。
(4)向“滤液Ⅲ”中通入过量CO2,生成沉淀的离子方程式为__。
(5)电解Al2O3制备Al需要冰晶石(Na3AlF6)作助熔剂。Na3AlF6可由Al(OH)3、Na2CO3和HF反应制得,反应的化学方程式为__。
(6)某工厂利用上述流程从m吨粉煤灰中制得n吨Al2O3,则原粉煤灰中铝的质量分数为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】某些共价键的键能数据如表(单位:kJmol-1):
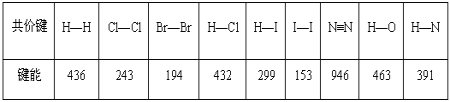
(1)把1mol Cl2分解为气态原子时,需要___(填“吸收”或“放出”)243kJ能量。
(2)由表中所列化学键形成的单质分子中,最稳定的是___;形成的化合物分子中最不稳定的是___。
(3)发射火箭时用气态肼(N2H4)作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知32gN2H4(g)完全发生上述反应放出568kJ的热量,热化学方程式是:____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液。
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体________g。
(2)从下图中选择称量NaOH固体所需要的仪器(填字母):________。

Ⅱ.测定稀硫酸和稀NaOH中和热的实验装置如下图所示。

(1)写出该反应的热化学方程式(中和热ΔH=-57.3 kJ·mol-1): _______________。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:

1_______________2___________________3_______________________4________________________5温度差平均值____
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=________(取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是________(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表与元素周期律在学习、研究和生产实践中都有非常重要的作用。下表(元素周期表前三周期的一部分)列出了①~⑦七种元素在周期表中的位置。
① | ② | ③ | |||
④ | ⑤ | ⑥ | ⑦ |
请回答:
(1)②所代表元素的名称为______
(2)七种元素中,非金属性最强的元素是______(填元素符号),最高价氧化物的水化物酸性最强的是_______(填化学式),最高正化合价与最低负化合价的代数和为4的元素是_______(填元素符号)。
(3)②、④、⑥所对应元素中原子半径最小的是______(填元素符号),简单离子半径最大的是______(填离子符号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知2 mol氢气燃烧生成液态水时放出572 kJ热量,反应方程式是
2H2(g)+O2(g)==2H2O(l)
(l)请回答下列问题:
①该反应的生成物能量总和________(填“大于”、“小于”或“等于”)反应物能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量________(填“>”、“<”或“=”)572 kJ。
③与化石燃料相比,利用氢能源有很多优点,请说出其中一点______________________。
(2)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学想通过实验探究硫和碳得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验。
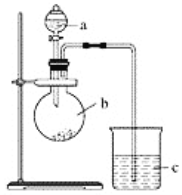
(1)仪器a的名称是________,应盛放下列药品中的________(填字母)。
A.稀硫酸 B.亚硫酸C.氢硫酸 D.盐酸
(2)仪器b的名称是________,应盛放下列药品中的________(填字母)。
A.碳酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3)仪器c中应盛放的试剂是________,如果看到的现象是____________________,证明b中反应产生了________,即可证明________比________酸性强,得电子能力________比________强,b中发生反应的离子方程式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com