
科目: 来源: 题型:
【题目】如图所示,若电解5min时铜电极质量增加2.16g,试回答(硝酸银足量):
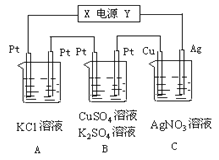
(1)电源电极X名称为____。
(2)通电5min时,B中共收集到224mL气体(标况),溶液体积为200mL,则通电前硫酸铜溶液的物质的量浓度为____。
(3)若A中KCl溶液的体积也是200mL(KCl足量,不考虑氯气的溶解),电解后溶液的c(OH-) =____。
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法错误的是
A.常温常压下,9.5g羟基(—18OH)中所含中子数为5NA
B.室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
C.2molFeBr2与足量氯气反应时,转移的电子数为6NA
D.甲烷燃料电池的正极消耗22.4LO2(标准状况下),电路中通过的电子数为4NA
查看答案和解析>>
科目: 来源: 题型:
【题目】碘在科研与生活中有重要应用,某兴趣小组用0.50mol·L-1KI、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知S2O82-+2I-=2SO42-+I2(慢) I2+2S2O32-= 2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的___耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为n(S2O32-)∶n(S2O82-)___。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如表
实验序号 | 体积V/mL | ||||
K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx__mL,理由是___。
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)____
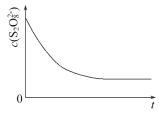
查看答案和解析>>
科目: 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极极板,通过导线与直流电源相连。下列说法不正确的是 ( )
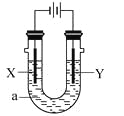
A. 若电镀铜,则Y为铜电极,电解液a可以是硫酸铜或氯化铜溶液
B. 若X为铁电极、Y为石墨电极,电解饱和氯化钠溶液一段时间,在两极分别滴加酚酞,X极变红色
C. 若用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.1mol的氢氧化铜溶解,刚好恢复到通电前的浓度,则电解过程中转移的电子为0.2mol
D. 若X、Y为铂电极,a溶液为250mL CuSO4和KNO3的混合液,经过一段时间后,两极均得到标准状况下5.6L气体,则原混合液中CuSO4的物质的量浓度为1mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸锌是一种重要的工业原料,广泛用于农业、化工、电镀等行业。工业上由锌渣(主要成分为ZnO、FeO、CuO、PbO等)等工业废料生产ZnSO4·7H2O的流程如下:
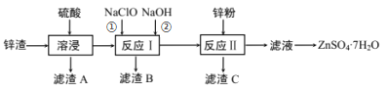
(1)“溶浸”操作中,写出加快“锌渣”“溶浸”速率的两种措施_____________。
(2)“滤渣A”的主要成分是________;“滤渣C”的主要成分是________。
(3)“反应Ⅰ”中①,先加入NaClO反应的离子方程式为____________;“反应Ⅰ”中②,再加入NaOH调节溶液pH约为_________,则滤液中Fe元素浓度小于4×105mol·L-1,而基本存在于“滤渣B”中。(Ksp[Fe(OH)3]=4×1038)
(4)“反应Ⅱ”中,加入的锌粉需用少量稀硫酸处理,原因是_________。
(5)在实验室中,由滤液获得ZnSO4·7H2O晶体的具体实验操作有_____________。
(6)取28.7g ZnSO4·7H2O加热至不同温度,剩余固体的质量如下表:
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 17.90 | 16.10 | 13.43 | 8.10 |
则680℃时所得固体的化学式为_________(填字母标号)。
A.ZnO B.ZnSO4 C. Zn3O(SO4)2 D.ZnSO4·H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH +2H2O![]() Cd(OH)2 + 2Ni(OH)2有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2-e-+ OH-=NiOOH + H2O
B.放电时负极附近溶液的pH不变
C.放电时电解质溶液中的OH-向正极移动
D.充电时Cd与外电源的正极相连
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,将3molSO2和1 molO2充入一定容密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+ O2(g)![]() 2SO3(g) △H=-197kJ/ mol,当达到平衡状态时,下列说法中正确的是
2SO3(g) △H=-197kJ/ mol,当达到平衡状态时,下列说法中正确的是
A.SO2与O2的转化率可能相等
B.容器中一定存在n(SO2)>1mol且n(SO3)<2mol
C.放出的热量为197kJ
D.当O2的转化率为50%时SO2和SO3 的物质的量一定相等
查看答案和解析>>
科目: 来源: 题型:
【题目】橡皮筋在拉伸和收缩状态时结构如图:在其拉伸过程中有放热现象,反之吸热。25℃、101kPa时,下列化学反应的焓变、熵变和自发性与橡皮筋从拉伸状态到收缩状态一致的是

A.2Na+2H2O=2NaOH+H2↑
B.Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
C.2H2+O2=2H2O
D.CaCO3=CaO+CO2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各项叙述中不正确的是( )
A.小苏打是面包发酵粉的主要成分之一
B.侯氏制碱法的工艺过程中应用了物质溶解度的差异
C.用酚酞溶液可鉴别饱和食盐水和饱和纯碱溶液
D.NaHCO3的热稳定性大于Na2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】丹参素(I)是一种具有改善心脏功能、抗血栓形成、促进组织的修复与再生等多种作用的药物。该药物的一种合成路线如下:
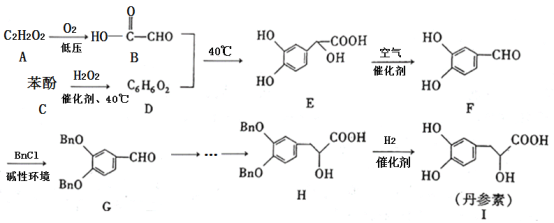
已知:![]() 代表苄基(
代表苄基(![]() )
)
请回答下列问题:
(1)![]() 的结构简式为_______,
的结构简式为_______,![]() 中所含官能团的名称为羟基、______。
中所含官能团的名称为羟基、______。
(2)![]() 的反应类型为_______,该反应的目的是________。
的反应类型为_______,该反应的目的是________。
(3)写出![]() 的化学方程式:________。
的化学方程式:________。
(4)苯酚与![]() 反应可以制备物质
反应可以制备物质![]() (
(![]() )。
)。![]() 是
是![]() 的同系物,相对分子质量比
的同系物,相对分子质量比![]() 大14。则符合下列条件的
大14。则符合下列条件的![]() 的同分异构体有______种(不考虑立体异构)。
的同分异构体有______种(不考虑立体异构)。
①苯环上只有两个取代基 ②能与![]() 溶液发生显色反应 ③能发生银镜反应 ④红外光谱表明分子中不含醚键
溶液发生显色反应 ③能发生银镜反应 ④红外光谱表明分子中不含醚键
其中核磁共振氢谱有6组峰,且峰面积之比为![]() 的结构简式为________(写出一种即可)。
的结构简式为________(写出一种即可)。
(5)参照丹参素的上述合成路线,以![]() 为原料,设计制备
为原料,设计制备![]() 的合成路线:____________。
的合成路线:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com