
科目: 来源: 题型:
【题目】关于反应3Cl2+6KOH![]() KClO3+5KCl+3H2O,以下说法正确的是( )
KClO3+5KCl+3H2O,以下说法正确的是( )
A.Cl2是氧化剂,KOH是还原剂
B.被氧化的氯元素的质量是被还原的氯元素质量的5倍
C.3 mol氯气参加反应转移6 mol电子
D.KOH、KCl和KClO3 都是电解质
查看答案和解析>>
科目: 来源: 题型:
【题目】有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:
①将固体混合物溶于水中,搅拌后得无色透明溶液;
②往此溶液中滴加硝酸钡溶液,有白色沉淀产生;
③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是________,一定不含有的物质是________,可能含有的物质是________(以上空格均填写化学式)。对可能含有的物质,可采用向滤液中滴加___________________溶液的方法来检验。
(2)写出步骤③中的离子方程式__________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】依据事实,写出反应的热化学方程式或计算反应热.
(1)在25℃、101kPa下,1g液态甲醇燃烧生成CO2和液态水时放出22.5kJ热量.则该反应的热化学方程式为_____.
(2)已知下列反应的反应热为:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=﹣880kJ/mol.
②C(s)+O2(g)═CO2(g)△H2=﹣393 kJ/mol.
③H2(g)+![]() O2(g)═H2O(l)△H3=﹣285.8kJ/mol
O2(g)═H2O(l)△H3=﹣285.8kJ/mol
则反应:C(s)+2H2(g)+CO2(g)=CH3COOH(l)△H=_____kJmol﹣1.
查看答案和解析>>
科目: 来源: 题型:
【题目】某抗肿瘤药物的有效成分为E,其一种合成路线如图:
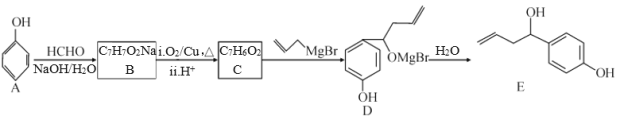
回答下列问题:
(1)质谱图显示有机物A的最大质荷比为___。
(2)E分子中官能团的名称是___;A→B的反应类型包括中和反应和___。
(3)常温下,E不能与下列试剂反应的是___(填字母)。
a.H2 b.FeCl3溶液 c.溴水 d.NaHCO3
(4)在冰水浴条件下,E与乙酸酐[(CH3CO)2O]反应生成一种香料M,1个M分子中含2个酯基。由E合成M的化学方程式为___。
(5)T是C的同系物,T的相对分子质量比C多28,则T的同分异构体中,满足下列条件的同分异构体有___种(不考虑立体异构)。
①属于芳香族化合物②既能发生水解反应又能发生银镜反应
其中核磁共振氢谱有4组峰且峰面积之比为1:1:2:6的T的所有可能结构为___。
(6)已知:RBr![]() RMgBr。设计由环己烯和乙醛制备化合物
RMgBr。设计由环己烯和乙醛制备化合物![]() 的合成路线___(无机试剂和某些有机试剂任选)。
的合成路线___(无机试剂和某些有机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(1)被氧化的元素是_________,被还原的元素是________;
(2)氧化剂与还原剂的物质的量之比是_________________;
(3)用双线桥法分析上述反应的电子转移方向和数目____________
查看答案和解析>>
科目: 来源: 题型:
【题目】CO和H2在一定条件下可以合成乙醇:2CO(g) + 4H2(g)![]() CH3CH2OH(g) + H2O(g),下列叙述中,能说明上述反应在一定条件下一定达到最大限度的是
CH3CH2OH(g) + H2O(g),下列叙述中,能说明上述反应在一定条件下一定达到最大限度的是
A. CO全部转化为乙醇
B. 断4NA个H-H键的同时,生成46g乙醇
C. 若反应在恒温恒容密闭容器中进行,容器中混合气体的密度不再改变
D. 若反应在绝热恒容密闭容器中进行,容器中温度不再改变
查看答案和解析>>
科目: 来源: 题型:
【题目】丙烯酸甲酯(CH2=CH—COOCH3)是一种重要的有机合成中间体,沸点为80.5℃。某实验小组制取丙烯酸甲酯的装置如图所示:

回答下列问题:
I.丙烯酸甲酯的制备与提纯
步骤1:将10.0g丙烯酸、6.0g甲醇和2mL浓硫酸放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热。
步骤2:充分反应后,冷却,向混合液中加入5%Na2CO3溶液洗至中性,分离出有机相。
步骤3:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙烯酸甲酯。
(1)步骤1装置如图1所示(加热和夹持装置已略去)。三颈烧瓶中进行的可逆反应化学方程式为___,本实验中最容易产生的副产物的结构简式为___。
(2)仪器b的作用为___。
(3)混合液用5%Na2CO3溶液洗涤的目的是___。
(4)实验室配制100g5%Na2CO3溶液需用到的玻璃仪器是___。
(5)关于产品的蒸馏操作(夹持装置未画出)如图2所示。将步骤3(蒸馏)的操作补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,___,弃去前馏分,收集80.5℃的馏分。
II.丙烯酸甲酯含量的测定
步骤1:将油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol·L-1的KOH溶液10.00mL,加热使之完全水解。
步骤2:用酚酞作指示剂,向冷却后的溶液中滴加0.5mol·L-1的HCl溶液,中和过量的KOH,滴到终点时共消耗盐酸20.00mL。
(6)本次酯化反应丙烯酸的转化率为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温恒容的容器中进行反应N2(g)+3H2(g) ![]() 2NH3(g),若氮气浓度由0.1 mol·L-1降到0.06 mol·L-1需2 s,那么由0.06 mol·L-1降到0.024 mol·L-1需要的反应时间为
2NH3(g),若氮气浓度由0.1 mol·L-1降到0.06 mol·L-1需2 s,那么由0.06 mol·L-1降到0.024 mol·L-1需要的反应时间为
A. 等于1.8 s B. 等于1.2 s C. 大于1.8 s D. 小于1.8 s
查看答案和解析>>
科目: 来源: 题型:
【题目】铅蓄电池的两极分别为Pb、PbO2,电解质溶液为硫酸,工作时反应为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,下列结论正确的是
2PbSO4+2H2O,下列结论正确的是
A. Pb为正极被氧化
B. SO42-只向PbO2极移动
C. 电解质溶液密度不断减小
D. 溶液的pH不断减小
查看答案和解析>>
科目: 来源: 题型:
【题目】碳是地球上组成生命的最基本元素之一,与其他元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界。碳及其化合物在研究和生产中有许多重要用途。回答下列问题:
(1)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。
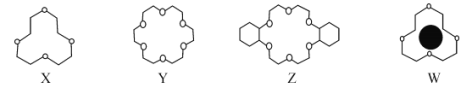
①Li+与X的空腔大小相近,恰好能进入到X的环内,且与氧原子的一对孤电子对作用形成稳定结构W(如图)。基态碳原子核外有___种运动状态不同的电子,其外围电子轨道表示式为___。W中Li+与孤对电子之间的作用属于___(填标号)。
A.离子键 B.共价键 C.氢键 D.配位键 E.以上都不是
②冠醚Y能与K+形成稳定结构,但不能与Li+形成稳定结构,理由是___。
③冠醚分子中氧的杂化轨道的空间构型是___,C—O—C的键角___(填“>”“<”或“=”)109°28′。
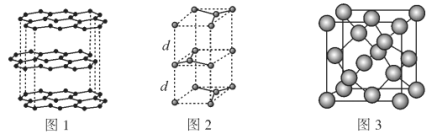
(2)碳的一种同素异形体——石墨,其晶体结构及晶胞如图1、图2所示。则石墨晶胞含碳原子个数为___个。已知石墨的密度为ρg·cm-3,C—C键键长为rcm,阿伏加德罗常数的值为NA,计算石墨晶体的层间距d为___cm。
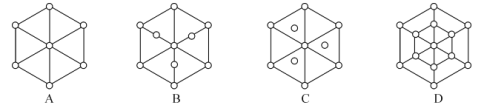
(3)碳的另一种同素异形体——金刚石,其晶胞如图3所示。已知金属钠的晶胞(体心立方堆积)沿其体对角线垂直在纸平面上的投影图如图A所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是图___ (从A~D图中选填)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com