
科目: 来源: 题型:
【题目】已知热化学方程式:则下列说法正确的是
①CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1

A. H2的燃烧热为241.8kJ·mol-1
B. 由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH =-41.2kJ·mol-1
C. H2(g)转变成H2O(g)的化学反应一定要释放能量
D. 根据②推知反应H2(g) +1/2O2(g)=H2O(l):ΔH>-241.8 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】CO和H2被称为合成气,用合成气可以合成乙酸。回答下列问题:
(1)已知CO、H2、CH3COOH的燃烧热分别为-283.0kJ/mol、-285.8kJ/mol、-1255.0kJ/mol,则用合成气合成CH3COOH(l)的可逆过程的热化学反应方程式为______;
(2)在密闭容器中发生合成乙酸的反应,下列可以提高CH3COOH产率的措施有________。
A.恒温恒容,通入少量氦气 B.及时分离出产物乙酸
C.加入高效催化剂 D.压缩容器体积
(3)在150℃时,2L的密闭容器中发生反应:2H2(g)+2CO(g)CH3COOH(g) ΔH>0,起始通入4molH2和4molCO,CH3COOH蒸汽的浓度数据随时间变化如下表所示:
时刻/min | 0 | 2 | 4 | 6 | 8 |
c(CH3COOH)/mol/L | 0 | 0.3 | 0.5 | 0.6 | 0.6 |
①0~2min内用CO表示该反应的速率为______,随着反应的进行速率逐渐减慢的可能原因是________;
②150℃时该反应的平衡常数的数值约为_________;(计算结果保留一位小数)
③平衡后再通入1molH2,则CH3COOH(g)的体积分数________,若再次通入1molH2和1molCO,则CH3COOH(g)的体积分数_________。(填“增大”“减小”或者“不变”)
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在固定容积的容器中,可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
A. 刚充入时反应速率υ正减少,υ逆增大 B. 平衡不发生移动
C. 平衡向正反应方向移动,A的物质的量浓度减小 D. 物质C的质量分数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】在不同情况下测得A(g)+3B(g)![]() 2C(g)+ 2D(s)的下列反应速率,其中反应速率最大的是
2C(g)+ 2D(s)的下列反应速率,其中反应速率最大的是
A. υ(D)=0.01 molL-1s-1 B. υ(C)=0.010 molL-1s-1
C. υ(B)=0.6 molL-1min-1 D. υ(A)=0.2molL-1min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是
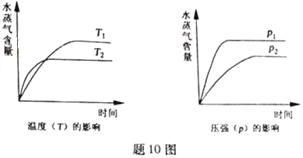
A. CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g);△H<0
CO(NH2)2(s)+H2O(g);△H<0
B. CO2(g)+H2(g)![]() CO(g)+H2O(g);△H>0
CO(g)+H2O(g);△H>0
C. CH3CH2OH (g)![]() CH2=CH2(g)+H2O(g);△H>0
CH2=CH2(g)+H2O(g);△H>0
D. 2C6H5CH2CH3(g)+O2(g)![]() 2 C6H5CH=CH2(g)+2H2O(g);△H<0
2 C6H5CH=CH2(g)+2H2O(g);△H<0
查看答案和解析>>
科目: 来源: 题型:
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。
(1)+6价的Cr能引起细胞的突变而对人体不利,可用亚硫酸钠将其还原。离子反应方程式为:3SO32-+Cr2O72-+8H+===2Cr3++3SO42-+4H2O,该反应氧化剂和还原剂的物质的量之比为___________。
(2)工业上利用铬铁矿( FeO. Cr2O3)冶炼铬的工艺流程如图所示:
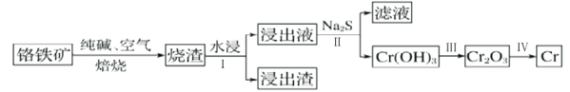
①为加快焙烧速率和提高原料的利用率,可采取的措施之一是___________。
②水浸Ⅰ要获得浸出液的操作是___________。
③浸出液的主要成分为Na2CrO4,加入Na2S反应后有Na2SO4生成,则操作Ⅱ发生反应的离子方程式为___________。
(3)常温下Cr(OH)3的溶度积Ksp=1×10-32,若要使Cr3+完全沉淀pH为___________[c(Cr3+)降至10-5mol·L-1可认为完全沉淀]。
(4)以铬酸钠(Na2CrO4)为原料,用电化学法可制备重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2CrO42-+2H+=Cr2O72-+H2O)。
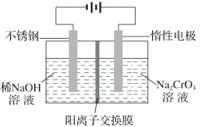
①阳极的电极反应式为___________。
②电解一段时间后,测得阳极区溶液中Na+物质的量由amol变为bmol,则生成重铬酸钠的物质的量为___________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:pAg=-lgc(Ag+),Ksp(AgCl)=1×10-12,Ksp (AgI)=1×10-16。如图是向10mLAgNO3溶液中逐滴滴入0.1mo1·L-1的NaCl溶液时,pAg随着加入NaCl溶液的体积变化的图像(实线)。下列叙述正确的是
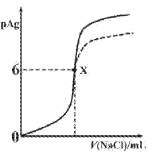
A. 原AgNO3溶液的物质的量浓度为0.1mol·L-1
B. 图中x点表示溶液中Ag+恰好完全沉淀
C. 图中x点的坐标为(10,6)
D. 若把NaCl溶液换成0.1mol·L-1NaI溶液,则图像在终点后变为虚线部分
查看答案和解析>>
科目: 来源: 题型:
【题目】某课题研究小组设计如下图所示装置(电极材料均为铂),该装置可将工业废水中的乙胺(CH3CH2NH2)转化成无毒无害物质。下列分析错误的是

A. 电极N为电池的负极
B. 电池工作时,H+由右极区通过交换膜移动到左极区
C. N电极的电极反应方程式为2CH3CH2NH2+8H2O-30e-=4CO2↑+N2↑+30H+
D. 当空气(假设含氧气20%)的进入量为7.5mol时,可以处理含乙胺9%(质量分数)的废水0.1kg
查看答案和解析>>
科目: 来源: 题型:
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10﹣5 |
下列说法不正确的是
A. 上述生成Ni(CO)4(g)的反应为放热反应
B. 25℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10﹣5
C. 80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2 mol/L
D. 在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时v(正)>v(逆)
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W、M均为短周期主族元素,原子序数依次增大,X质子总数与电子层数相同,Y元素的一种同位素可用于考古时测定一些文物的年代,Z的气态氢化物可以与Cl2反应产生白烟,用来检验氯气管道是否泄漏。Y、Z、W位于同一周期,且最外层电子数之和为15,M的质子数是X、Y、Z、W四种元素质子数之和的![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.简单离子半径M>W>Z>X
B.M2W2与足量的CO2完全反应,转移2 mol电子时增重28 g
C.X、Z两种元素只能组成化学式为ZX3的化合物
D.由X、Z、W三种元素形成的化合物既有共价化合物也有离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com