
科目: 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)![]() 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A. m=2
B. 两次平衡的平衡常数相同
C. X与Y的平衡转化率之比为1:1
D. 第二次平衡时,Z的浓度为0.4 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】某试液中只可能含有K+、NH![]() 、Fe2+、Al3+、Cl-、SO
、Fe2+、Al3+、Cl-、SO![]() 、CO
、CO![]() 、AlO
、AlO![]() 中的若干种离子,离子浓度均为0.1mol·L1,某同学进行了如下实验,下列说法正确的是( )
中的若干种离子,离子浓度均为0.1mol·L1,某同学进行了如下实验,下列说法正确的是( )
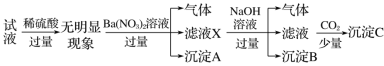
A.无法确定原试液中是否含有Al3+、Cl-
B.原溶液中存在NH![]() 、Fe2+、Cl-、SO
、Fe2+、Cl-、SO![]()
C.无法确定沉淀C的成分
D.滤液X中大量存在的阳离子有NH![]() 、Fe2+和Ba2+
、Fe2+和Ba2+
查看答案和解析>>
科目: 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
①2NO(g)+Cl2(g)![]() 2ClNO(g) ΔH1<0,平衡常数为K1;
2ClNO(g) ΔH1<0,平衡常数为K1;
②2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) ΔH2<0,平衡常数为K2。
NaNO3(s)+ClNO(g) ΔH2<0,平衡常数为K2。
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) ΔH3,平衡常数K=___________________(用K1、K2表示)。ΔH3=___________(用ΔH1、ΔH2表示)。
2NaNO3(s)+2NO(g)+Cl2(g) ΔH3,平衡常数K=___________________(用K1、K2表示)。ΔH3=___________(用ΔH1、ΔH2表示)。
(2)为研究不同条件对反应①的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应①达到平衡。测得10 min内v(ClNO)=7.5×10-3mol·L-1·min-1,则平衡后n(Cl2)=__________mol,NO的转化率α1=___________。其他条件保持不变,反应①在恒压条件下进行,平衡时NO的转化率为α2,α1____α2(填“>”“<”或“=”),平衡常数K1______________(填“增大”“减小”或“不变”)。若要使K1减小,可采用的措施是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_________________________。
(2)该反应为____________(填“吸热”或“放热”)反应。
(3)能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。
(5)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则下一时刻,反应向________(填“正向”或“逆向”)进行。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是实验室干馏煤的装置图,结合下图回答问题。

(1)指出图中仪器名称:a__________;b__________;c__________;d__________。
(2)装置c的作用是____________________________________,d中的液体有________和________。有机物可以通过________的方法使其中的重要成分分离出来。
(3)e处点燃的气体是________,火焰的颜色是________色。
(4)下列叙述错误的是________。
A.煤发生了化学变化
B.d中液体显碱性
C.d中液体不分层
D.e处的气体可以还原氧化铜,也可以使溴水褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】下列解释事实的化学用语正确的是
A.用饱和 Na2CO3 溶液浸泡锅炉水垢除去其中的 CaSO4:CO![]() + CaSO4
+ CaSO4![]() CaCO3 + SO
CaCO3 + SO![]()
B.用白醋和淀粉 KI 试纸检验加碘盐中的 KIO3:5I + IO![]() + 3H2O = 3I2 + 6OH-
+ 3H2O = 3I2 + 6OH-
C.碱性条件下,用 KClO 溶液与 Fe(OH)3 反应制备新型净水剂 K2FeO4: 3ClO + 2Fe(OH)3 = 2FeO![]() + 3Cl + 4H+ + H2O
+ 3Cl + 4H+ + H2O
D.氯碱工业制备氯气:2Cl + 2H+ ![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】海水的综合利用可以制备金属镁,其流程如下图所示:
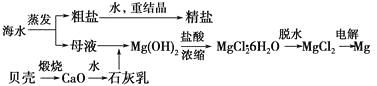
(1)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。__________________________
(2)实验室将粗盐制成精盐的过程中,溶解、过滤、蒸发三个步骤的操作都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
①溶解:________________。
②过滤:__________________________。
③蒸发:________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
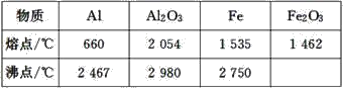
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理_(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是__,反应的离子方程式为_。
(3)实验室溶解该熔融物,下列试剂中最好的是__(填序号),并说明理由:__。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用铝土矿(主要成份是Al2O3,还含有Fe2O3、SiO2)提取氧化铝冶炼铝的原料(纯净的Al2O3),提取操作过程如下:
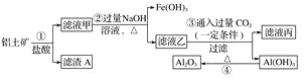
请回答下列问题:
(1)请写主要成份的化学式:滤渣A________,滤液丙中的溶质是NaCl和________。
(2)反应②中Al3+反应的离子方程式为_________________;反应③的离子方程式为____________;反应④的化学方程式为______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,将2mol A和2mol B两种气体混合于2L密闭容器中,发生反应3A(g)+B(g)xC(g)+2D(g),2min末反应达到平衡状态,生成0.8mol D,并测得C的浓度为0.4mol/L。由此推断:
(1)x值等于______________
(2)B的平衡浓度为_____________
(3)A的转化率为____________
(4)生成D的反应速率______________
(5)如果增大反应体系的压强,则平衡体系中C的质量分数____________(填“增大”或“减小”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com