
科目: 来源: 题型:
【题目】已知A为正盐。根据下列变化进行推断,回答有关问题:

(1)推断A、B、C、D的化学式:A________、B________、C________、D________。
(2)写出下列反应的离子方程式:
反应①生成气体B:__________________________________________________;
反应②白色沉淀溶解:________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)将氨气通入水中,发生化学反应的方程式有_______;下列有关分析中正确的是_______;
A.常温时氨气易溶于水
B.通常情况下氨气在水中的溶解度不大
C.溶于水的氨气分子有少量发生电离
D.氨水中的NH3H2O可电离出少量OH-
E.氨本身具有弱碱性
F.在饱和氨水中含量最多的溶质是NH3H2O
(2)氨水有许多用途,请任写一个用氨水制取不溶性碱的方程式_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA是阿伏加德罗常数的值。下列说法正确的是( )
A.1molNaHSO4固体中含有离子总数为3NA
B.11.2L(标准状况)HF含有质子数为5NA
C.50g46%的乙醇水溶液中,含有O—H键数为3.5NA
D.1molCu与足量的硫蒸气反应,转移电子数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与环境、科学、技术密切相关。下列有关说法中正确的是( )
A.华为首款5G手机搭载了智能的7nm制程SoC麒麟980芯片,此芯片主要成分是二氧化硅
B.用于制作N95型口罩的“熔喷布”主要原料是聚丙烯,聚丙烯的分子长链上无支链
C.国产飞机C919用到的氮化硅陶瓷是传统有机非金属材料
D.侯氏制碱法的工艺过程中应用了物质溶解度的差异
查看答案和解析>>
科目: 来源: 题型:
【题目】氮元素是地球大气中含量最多的元素,请完成下列有关问题:
(1)写出氮元素的原子结构示意图:_____________。
(2)通常情况下,氮气性质不活泼,其原因是__________。
A.氮分子是双原子分子 B.氮元素的非金属性很强
C.氮原子的半径较小 D.破坏氮分子中的化学键很难
(3)N2的电子式:__________,将空气中的氮气转化为氮的化合物的过程称为固氮。下列能实现人工固氮的是_______
A.N2和H2在一定条件下反应生成NH3
B.雷雨闪电时空气中的N2和O2化合生成NO
C.NH3经过催化氧化生成NO
D.NH3和HNO3反应生成NH4NO3
(4)氨气的电子式:__________________。
(5)实验室通常用加热消石灰与氯化铵固体的方法来制取氨气。写出此反应的化学方程式______________。
(6)下面是实验室制取氨气的装置和选用的试剂,其中错误的是________。
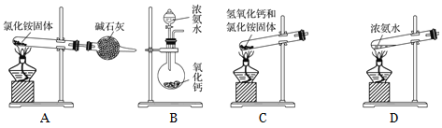
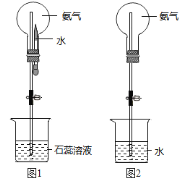
(7)用圆底烧瓶收集干燥的氨气,用图1装置进行喷泉实验,挤压滴管的胶头时,可以得到红色喷泉,原因(用方程式表示) _________________________。
(8)如果只提供如图2的装置,请说明引发喷泉的方法__________________________。
(9)NH4NO3是常用的铵态氮肥,在施用时若受热会释放出________而降低肥效。检验NH4+的方法是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定某硬铝(含有铝、镁、铜)中铝的含量,设计了Ⅰ、Ⅱ两个方案。根据方案Ⅰ、Ⅱ回答问题:
方案Ⅰ:
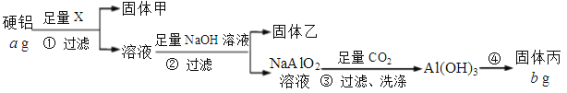
(1)固体甲是铜,试剂X的名称是_______________。
(2)能确认NaOH溶液过量的是___________(选填选项)。
a. 测溶液pH,呈碱性
b. 取样,继续滴加NaOH溶液,不再有沉淀生成
c. 继续加NaOH溶液,沉淀不再有变化
(3)步骤④的具体操作是:灼烧、_______、________,重复上述步骤至恒重。
(4)固体丙的化学式是______,该硬铝中铝的质量分数为_______________。
方案Ⅱ的装置如图所示:
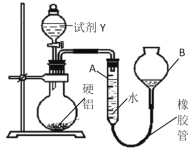
操作步骤有:
①记录A的液面位置;
②待烧瓶中不再有气体产生并恢复至室温后,使A和B液面相平;
③再次记录A的液面位置;
④将一定量Y(足量)加入烧瓶中;
⑤检验气密性,将a g硬铝和水装入仪器中,连接好装置。
(1)试剂Y是________________;操作顺序是______________________。
(2)硬铝质量为a g,若不测气体的体积,改测另一物理量也能计算出铝的质量分数,需要测定的是_______,操作的方法是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高温下,Fe2O3和H2反应可转化为Fe3O4,方程式为3Fe2O3+H2![]() 2Fe3O4+H2O。下列说法正确的是( )
2Fe3O4+H2O。下列说法正确的是( )
A.Fe2O3俗名磁性氧化铁
B.该反应条件下H2的还原性强于Fe3O4的还原性
C.每消耗160 g Fe2O3,反应中转移2×6.02×1023个电子
D.Fe3O4可由Fe与H2O在常温下反应制得
查看答案和解析>>
科目: 来源: 题型:
【题目】氨的催化氧化是制硝酸的主要反应之一,其微观示意图如下。下列说法正确的是( )

A.甲的化学式为NH3 , 其水溶液呈碱性B.该反应中元素的化合价都发生改变
C.该反应中甲、乙的质量比为17 :32D.生成物丙、丁的分子个数比为1:2
查看答案和解析>>
科目: 来源: 题型:
【题目】铝、铁是常见的金属,其化合物也有广泛的用途。回答下列问题:
(1)氢氧化铝是一种两性氢氧化物,写出它的电离方程式___,将少量的稀盐酸逐渐滴入NaAlO2溶液,产生的现象为___,用平衡移动原理来解释这一现象:___。
(2)明矾可以用于净水,用离子反应方程式来解释原理:___,将Ba(OH)2溶液滴入明矾溶液中,当SO42-完全沉淀,则铝元素在溶液中存在的形式为___(用化学式表示)。
(3)高铁酸钠(Na2FeO4)可用作高效水处理剂,既可以杀菌消毒,又可以除去水中的悬浮颗粒物,请用你所学过的化学原理加以解释。___。
查看答案和解析>>
科目: 来源: 题型:
【题目】2020年5月5日晚18时00分,我国载人空间站货物返回舱试验舱在我国文昌航天发射场点火升空,5月8日飞船试验船返回舱在东风着陆场预定区域成功着陆,试验取得圆满成功。金属铍(Be)是火箭、航空、宇宙航行的重要材料,工业上以含铍废渣(主要成分是Be和MgF2)为原料制备金属铍的工艺流程。如图:
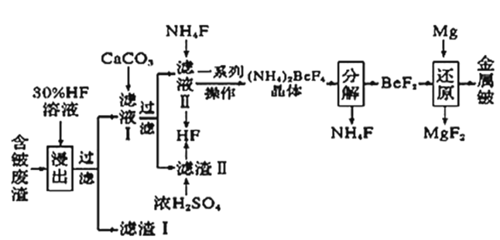
已知:MgF2和CaF2难溶于水。回答下列问题:
(1)提高浸出速率的方法有___、__(任写两项);已知滤液Ⅰ中铍元素的存在形式为H2BeF4,写出“浸出”过程中发生反应的化学方程式:__。
(2)该流程中可循环利用的物质是__;滤渣Ⅱ与浓硫酸发生反应的化学方程式为___;已知(NH4)2BeF4易溶于水,且其在水中的溶解度随温度的升高而大幅度增大,从NH4F与滤液Ⅱ发生反应后所得溶液中获得(NH4)2BeF4晶体的“一系列操作”具体是指__过滤、洗涤、干燥。
(3)“分解”过程中产生的BeF2在熔融状态下不能导电,其电子式为___;“还原”过程可以用金属镁制备金属铍的原因是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com