
科目: 来源: 题型:
【题目】某化学小组同学探究在实验室中![]() 检验的干扰因素。
检验的干扰因素。
(1)检验溶液中是否含有![]() 时先用过量盐酸将溶液酸化,其目的是排除_______________、
时先用过量盐酸将溶液酸化,其目的是排除_______________、![]() 、Ag+等离子可能造成的干扰。
、Ag+等离子可能造成的干扰。
(2)为了验证盐酸能否排除![]() 的干扰,该小组同学进行了如下实验:
的干扰,该小组同学进行了如下实验:
Ⅰ.量取一定体积的浓盐酸(盛放浓盐酸试剂瓶的标签中部分信息如下图),稀释,配制成 5 mol/L 的稀盐酸。

Ⅱ.甲同学取 0.3 g 未变质的 Na2SO3 固体,向其中加入上述 5mol/L 稀盐酸至过量,产生大量气泡。充分振荡后滴加 4 滴BaCl2 溶液,迅速产生白色浑浊,产生白色浑浊的原因可能是:
①______________。
②盐酸中含有 Fe3+,实验证实含有 Fe3+的方案是:___________________,用离子方程式解释由 Fe3+产生白色浑浊的原因:__________。
(3)乙同学提出,检验![]() 时能否用硝酸酸化来排除
时能否用硝酸酸化来排除![]() 的干扰,丙同学认为不可行,理由是(用离子方程式表示)____________________________,继续实验:称取 5 份 0.3 g 未变质的Na2SO3 固体,分别向其中加入 10 mL 不同浓度的硝酸, 振荡;再滴加 4 滴BaCl2 溶液,观察并记录实验现象如下表。
的干扰,丙同学认为不可行,理由是(用离子方程式表示)____________________________,继续实验:称取 5 份 0.3 g 未变质的Na2SO3 固体,分别向其中加入 10 mL 不同浓度的硝酸, 振荡;再滴加 4 滴BaCl2 溶液,观察并记录实验现象如下表。
硝酸浓度(mol/L) | 滴加氯化钡溶液之前现象 | 滴加氯化钡溶液之后现象 |
15.0(浓硝酸) | 产生大量红棕色气体,溶液呈黄色 | 立即产生大量白色沉淀 |
7.5 | 产生大量红棕色气体,溶液呈淡黄色 | 立即产生大量白色沉淀 |
4.8 | 产生少量无色、刺激性气味气体,溶液无色 | 开始无现象,约 60 min 后溶液开始变浑浊 |
2.0 | 产生少量无色、刺激性气味气体,溶液无色 | 开始无现象,约 70 min 后溶液开始变浑浊 |
0.5 | 产生少量无色、刺激性气味气体,溶液无色 | 开始无现象,约 120 min 后溶液开始变浑浊 |
依据上述实验得出的结论是:________________。
(4)丙同学查阅资料后提出:Cl-的存在也会对![]() 的检验产生干扰。在 Cl-催化作用下,稀硝酸可将
的检验产生干扰。在 Cl-催化作用下,稀硝酸可将![]() 氧化为
氧化为 ![]() 。为证明上述观点,设计如下实验,请将实验ⅱ的操作补充完整。
。为证明上述观点,设计如下实验,请将实验ⅱ的操作补充完整。
实验 | 实验操作 | 实验现象 |
ⅰ | 将 0.3 g Na2SO3 和 0.3 g NaCl 固体混合,加入 10 mL 2.0mol/L 的稀硝酸,振荡后,再滴加 4 滴 BaCl2 溶液。 | 立即产生大量白色沉淀。 |
ⅱ | ____________。 | 放置两小时后溶液未变浑浊。 |
查看答案和解析>>
科目: 来源: 题型:
【题目】在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质.下列实验现象和结论一致且正确的是
A. 加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B. 溶液呈黄绿色,且有刺激性气味,说明有HClO分子存在
C. 加入AgNO3溶液产生白色沉淀,说明有Cl-分子存在
D. 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
查看答案和解析>>
科目: 来源: 题型:
【题目】Fe3O4又称为磁性氧化铁,常用来制造录音磁带和电讯器材。其Fe(II)和Fe(III)的比值是评判磁粉质量优劣的重要指标,测定方法如下(杂质不含干扰测定):
I.准确称量mg磁粉样品溶于过量稀硫酸,配制成250.00mL溶液;
II.取25.00mL上述溶液,用0.0200mol/LKMnO4溶液滴定,消耗KMnO4溶液V1mL;
III.另取I溶液25.00mL,加入30%过氧化氢溶液,微热至无气泡后冷却至室温;
IV.向Ⅲ所得溶液中加入过量KI,密闭反应30min;
V.用0.3000mol/LNa2S2O3标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗Na2S2O3溶液V2mL。
已知:I2 + 2Na2S2O3 = 2NaI + Na2S4O6,Na2S2O3 和 Na2S4O6 溶液颜色均为无色
(1)Ⅰ中配制溶液用到的玻璃仪器有烧杯、玻璃棒、____________和______________。
(2)Ⅱ中发生反应的离子方程式是_____________。
(3)Ⅲ中加过氧化氢溶液时一定要过量,理由是______________。
(4)V 中滴定至终点的现象是_______________。
(5)磁粉中 Fe(II)和Fe(III)的物质的量之比为___________(写出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将1.12 g铁粉加入25 mL 2mol/L的氯化铁溶液中,充分反应后,其结果是
A. 铁有剩余,溶液呈浅绿色,Cl- 浓度基本不变
B. 往溶液中滴入无色KSCN溶液,显黄色
C. 氧化产物与还原产物的物质的量之比为2∶5
D. Fe2+和Fe3+的物质的量之比为6∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是种非常重要的化工原料,工业上CO2 用于生产燃料甲醇,既能缓解温室效应,也为甲醇的合成寻找了新渠道。
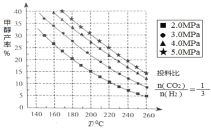
(1)甲醇的合成:合成甲醇的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H ;在催化剂作用下,测得甲醇的产率与反应温度、压强关系如下图所示, 由图中数据可知,△H______0(选 填“>”“<”“=”),甲醇产率随着压强变化呈现图示规律的原因是_______。
(2)甲醇的应用:丙炔酸甲酯是一种重要的有机化工原料,不溶于水,常温呈液态,沸点为 103~105 ℃。实验室可用甲醇和另一有机原料 M 在一定条件下制备,实验步骤如下:
步骤 1:在反应瓶中,加入 13 g 原料 M、50 mL 甲醇和 2 mL 浓硫酸,搅拌,加热回流一段时间。
步骤 2:蒸出过量的甲醇(装置见下图)。
步骤 3:反应液冷却后,依次用饱和 NaCl 溶液、 5%Na2CO3 溶液、水洗涤;分离出有机相。
步骤 4:有机相经无水 Na2SO4 干燥、过滤、蒸馏, 得丙炔酸甲酯。

①步骤 1 中反应的化学方程式是_____________。
②步骤 1 中,加入过量甲醇的目的是_____________。
③步骤 3 中 Na2CO3 溶液洗涤主要去除的物质是______。该步骤中不用等量等浓度的NaOH 溶液代替Na2CO3 溶液洗涤主要原因是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜是有机合成工业中应用较广的催化剂。
(1)CuCl用作制备碳酸二甲酯的催化剂:4CH3OH+2CO+O2![]() 2(CH3O)2CO+2H2O,请填写化学方程式将催化原理补充完整:i.4CuCl+4CH3OH+O2=4Cu(CH3O)Cl+2H2O;ii.________________________。
2(CH3O)2CO+2H2O,请填写化学方程式将催化原理补充完整:i.4CuCl+4CH3OH+O2=4Cu(CH3O)Cl+2H2O;ii.________________________。
(2)一种用废铜制备氯化亚铜的过程如下:
Cu(s)+Cl2(g)=CuCl2(s) △H=-a kJ·mol-1
CuCl2(s) +Cu(s) +4HCl(aq)=2H2[CuCl3] (aq) △H=+b kJ·mol-1
CuCl(s) + 2HCl(aq)H2[CuCl3] (aq) △H=-c kJ·mol-1
①反应 2Cu(s)+Cl2(g)=2CuCl(s) △H=_______________ kJ·mol-1(用含 a、b、c 的式子表示)
②向CuCl2 溶液中加入过量铜粉,发生反应生成CuC1。但在实验过程中要加入浓盐酸反应才能持续进行,反应结束后将溶液倒入蒸馏水中稀释获得CuCl。加入浓盐酸的目的是___________________。
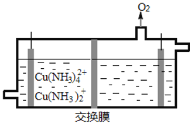
(3)在电解槽中电解氨性含铜蚀刻废液,电解后向阴极液中加入盐酸酸化,再倒入蒸馏水稀释,得到氯化亚铜沉淀。
①电解装置如图所示,阴极区电极方程式为___________________________ 。
②稀释过程中溶液的温度不同,得到沉淀质量和氯化亚铜百分含量变化如图所示。
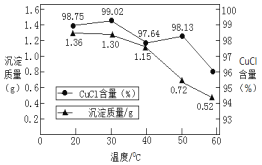
从氯化亚铜产率角度分析,最佳稀释温度为__________________;温度越高得到氯化亚铜沉淀质量越小,其原因可能是:i.加热过程中部分氯化亚铜被氧化;ii.___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室常用王水(浓硝酸和浓盐酸按体积比1:3的混合物)来溶解白金等贵金属进行科学实验。王教授用质量分数为63%的浓硝酸(密度1.40g/ ![]() )和质量分数为36.5%的浓盐酸(密度1.19g/
)和质量分数为36.5%的浓盐酸(密度1.19g/ ![]() )来配制王水600毫升,假设忽略两种酸混合时的体积变化也不考虑混合后的化学变化,下列说法错误的是
)来配制王水600毫升,假设忽略两种酸混合时的体积变化也不考虑混合后的化学变化,下列说法错误的是
A. 该王水中硝酸的物质的量浓度是3.5mol/L
B. 该王水中氧元素的质量是100.8g
C. 该王水的密度约为1.24g/ ![]()
D. 该王水中HCl的质量分数约为26.2%
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是
A.3g 3He含有的中子数为1NA
B.0.1 mol·L1碳酸钠溶液含有的CO32—数目为0.1NA
C.25℃,1.01×105Pa时,22.4LCO2中含有的氧原子数目小于2NA
D.a g正丁烷和b g异丁烷的混合物中共价键数目为13(a+b)NA/58
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com