
科目: 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如下图所示,对该反应的推断合理的是( )

A. 该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B. 反应进行到1 s时,v(A)=v(D)
C. 反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D. 反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温条件下,可逆反应:2NO(g)+O2(g)![]() 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态.
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目: 来源: 题型:
【题目】在建国70周年阅兵仪式上,“歼20”“东风-41 核导弹”等国之重器亮相,它们采用了大量合金材料。回答下列问题:
(1)查阅资料显示第二电离能 Cu 大于 Zn,理由是 _____________。
(2)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成 Ti(SO4)2、NiSO4,其中阴离子的立体构型为______,S的_____杂化轨道与O的2p轨道形成______键(填“π”或“σ”)。
(3)铁元素能与 CO 形成 Fe(CO)5。羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含___molσ键,与CO互为等电子体的一种离子的化学式为____。
(4)金属钛采用六方最密堆积的方式形成晶体,其晶胞的俯视图为__(填字母序号)。
A.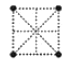 B.
B.  C.
C.  D .
D .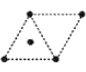
a. 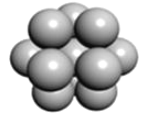 b.
b.  c.
c. 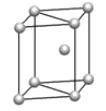
(5) 镁单质晶体中原子的堆积模型如图,它的堆积模型名称为__;晶胞是图中的_(填 a、b 或 c);配位数是___;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ gcm-3,已知阿伏德罗常数为NA,则镁的摩尔质量的计算式是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在温度不变、恒容的容器中进行反应2HI![]() H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L,需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为( )
H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L,需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为( )
A.等于10 sB.等于12 sC.大于12 sD.小于12 s
查看答案和解析>>
科目: 来源: 题型:
【题目】欲降低废水中重金属元素铬的毒性,可将![]() 转化为Cr(OH)3沉淀除去。几种金属离子生成沉淀的pH如下表。
转化为Cr(OH)3沉淀除去。几种金属离子生成沉淀的pH如下表。
阳离子 | Fe3+ | Fe2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | —— | —— |
沉淀完全时的pH | 3.2 | 9.0 | 9(>9溶解) | 8 |
(1)某含铬废水处理的主要流程如下图所示:

①初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)______________________________。
②请补充并配平以下反应池中发生主要反应的离子方程式:____![]() +____
+____![]() +____===____Cr3++____
+____===____Cr3++____![]() +____H2O。
+____H2O。
③根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-===H2O和_______________________________。证明Cr3+沉淀完全的方法是_____________________________________________________________。
(2)工业可用电解法来处理含![]() 的废水。实验室利用如图模拟处理含
的废水。实验室利用如图模拟处理含![]() 的废水,阳极反应是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。
的废水,阳极反应是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。

①Fe2+与酸性溶液中的![]() 反应的离子方程式是______________________________。
反应的离子方程式是______________________________。
② 若溶液中含有0.01 mol ![]() ,则阳离子全部生成的沉淀的物质的量是______mol。
,则阳离子全部生成的沉淀的物质的量是______mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年10月1日,我国成功举办国庆七十周年阅兵活动。其中阅兵仪式上混合动力车等新能源车辆的亮相,展示了综合国力、国防科技发展水平。同时也说明能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
工业上用天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH= +206.0kJmol-1
(ii)合成甲醇:CO(g)+2H2(g)CH3OH(g) ΔH= -90.67kJmol-1
(1)制备合成气:工业生产中为解决合成气中H2过量而 CO 不足的问题,原料气中需添加CO2,发生的反应(iii):CO2(g)+H2(g) CO(g)+H2O(g) ΔH= +41.17kJmol-1,为了使合成气配比最佳,理论上原料气中二氧化碳与甲烷质量比为 _______。
(2)为节约化石能源、减少碳排放,用CO2代替CO作为制备甲醇的碳源正成为当前研究的焦点。
①请写出二氧化碳加氢合成水蒸气和甲醇的热化学方程式____________。
②研究表明在二氧化碳合成甲醇的原料气的反应中,保持其它条件不变,采用Ⅰ、Ⅱ、Ⅲ三种催化剂,反应进行相同时间后,CO2的转化率随反应体系的温度变化如图所示:

a~d 点中反应一定处于平衡状态的点是____;CO2的转化率 a 点比 c 点高的原因是 ____。
③最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示:
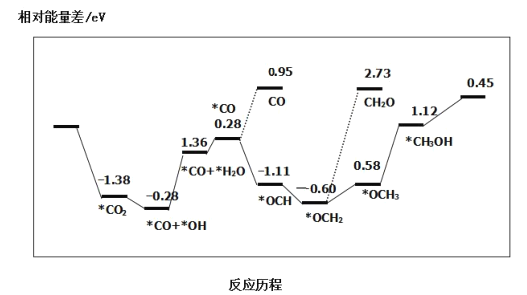
容易得到的副产物有 CO 和CH2O,其中相对较少的副产物为___;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中____(填字母)的能量变化。
A.*CO → *OCH B.*CO+*OH→*CO+*H2O
C.*OCH2→*OCH3D.*OCH3→*CH3OH
(3)在一容积可变的密闭容器中充入10molCO和20molH2合成甲醇,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
①比较A、B 两点压强大小PA_______PB填“>、<、 =”)
②若达到化学平衡状态 A 时,容器的体积为 10 L,如果反应开始时仍充入 10molCO和20molH2,则在平衡状态 B 时,容器的体积V(B)=_______L;
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)![]() 的分子式为_____________。
的分子式为_____________。
(2)写出![]() 中官能团的名称_________________。
中官能团的名称_________________。
(3)相对分子质量为72且沸点最低的烷烃的结构简式为__________________。
(4)有机物M(![]() )为苯的同分异构体,M的二氯代物的同分异构体有_____种。
)为苯的同分异构体,M的二氯代物的同分异构体有_____种。
(5)聚偏二氯乙烯(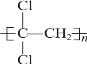 )具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。
)具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。
(6)写出异丁醛(![]() )与新制的氢氧化铜悬浊液共热的化学方程式:________。
)与新制的氢氧化铜悬浊液共热的化学方程式:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入1L1mol/L食盐水中。下列说法正确的是( )
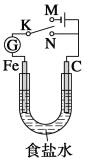
A.若电键K与N连接,铁被保护不会腐蚀
B.若电键K与N连接,正极反应式是4OH--4e-=2H2O+O2↑
C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜
D.若电键K与M连接,当两极共产生28L(标准状况)气体时,生成了1.25molNaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,在 20 mL 0.1 molL-1 一元弱酸HA溶液中滴加0. 1mol L-1 NaOH溶液,溶液中1g[c(A-)/c(HA)]与 pH 关系如图所示。下列说法正确的是
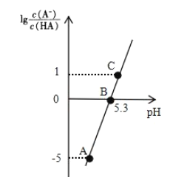
A.A点对应溶液中:c(OH-)>c(H+)
B.25℃时,HA电离常数的数量级为10-5
C.B点对应的 NaOH 溶液体积小于 10 mL
D.对C点溶液加热(不考虑挥发),则![]() 增大
增大
查看答案和解析>>
科目: 来源: 题型:
【题目】将2mol·L-1A气体和1mol·L-1B气体混合,并在一定条件下发生反应:2A(g)+B(g)![]() 2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
①用物质B表示的反应的平均速率为0.6mol·L-1·s-1
②用物质A表示的反应的平均速率为0.3mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol·L-1
其中正确的是( )
A.① ③B.③ ④C.② ③D.② ④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com