
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A. 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B. 室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
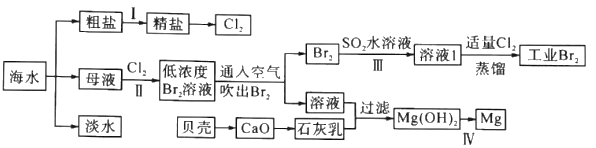
请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序正确的是______(填字母)。
A.①②③④ B.②③④① C.②④③① D.③④②①
请写出加入Na2CO3溶液后相关化学反应的离子方程式:_________、_________。
(2)步骤Ⅱ中已获得Br2,步骤Ⅲ中又将Br2还原为Br-,其目的是_________。步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_________。
(3)为了从工业Br2中提纯溴,除去产物中残留的少量Cl2.可向其中加入_________溶液。
(4)步骤Ⅳ由Mg(OH)2得到单质Mg,以下方法最合适的是_________(填序号)。
A. ![]()
B.![]()
C.![]()
D. ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下:
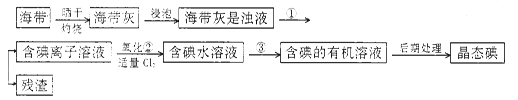
(1)指出提取碘的过程中有关的实验操作名称:①____________________;③______________。
若实验②中采用酸性条件下加入双氧水,则有关反应的离子方程式_________________________________。
(2)提取碘的过程中,可供选择的有关试剂是___________。
A.甲苯,酒精B.四氯化碳,苯C.汽油,乙酸D.汽油,甘油
(3)含碘的有机溶液后期处理得到晶态碘需要进行的操作为___________;
最后,晶态碘在___________里聚集。
查看答案和解析>>
科目: 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是__________。
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________、________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_______________。
②E处干燥管中盛放的药品是碱石灰,其作用是_____________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量_____________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。
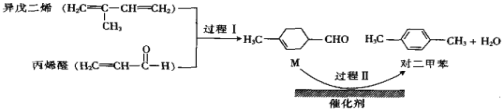
下列说法不正确的是( )
A.M的某种同分异构体含有苯环且能与钠反应放出氢气
B.可用溴水鉴别M和对二甲苯
C.对二甲苯的一氯代物有2种
D.异戊二烯所有碳原子可能共平面
查看答案和解析>>
科目: 来源: 题型:
【题目】在不同情况下测得A(g)+3B(g)![]() 2C(g)+2D(s)的下列反应速率,其中反应速率最大的是
2C(g)+2D(s)的下列反应速率,其中反应速率最大的是
A.v(D)=0.8molL-1s-1B.v(C)=0.010 molL-1s-1
C.v(B)=0.6 molL-1min-1D.v(A)=0.2molL-1min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】随着电子科技水平的进步,液晶电视、电脑、仪表等电子产品已进入我们的日常生活。下面是工业上用丙烯(A)和有机物 C(C7H6O3)为原料合成液晶显示器材料(F)的主要流程:
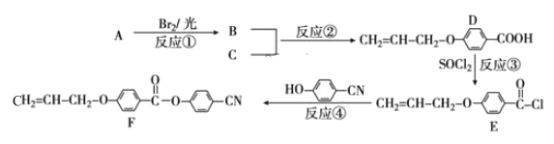
(1)化合物C的名称为_____;反应④的反应类型是 _____。
(2)D 中含氧官能团的名称为____;B的结构简式为 ______。
(3)写出C与足量 NaOH 水溶液反应的离子方程式______。
(4)写出所有符合下列条件下的化合物C的同分异构体的结构简式 ____。
①苯环上一溴代物只有 2 种 ②能发生银镜反应 ③苯环上有3个取代基
(5)化合物D是用于合成一种质子交换膜材料的重要原料。我国科研人员研发的一种质子交换膜材料的结构片段如下,它由三种单体缩聚而成。
已知:R1OH + R2Cl → R1—O—R2+ HCl,
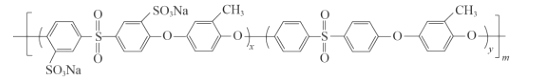
其单体的结构简式是: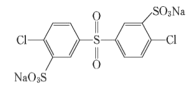 、________、________。
、________、________。
(6)请参照上述制备流程,写出以有机物C、乙烯、![]() 为原料制备
为原料制备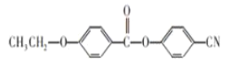 的合成路线流程图(无机试剂任用)__
的合成路线流程图(无机试剂任用)__
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯与甲苯都是重要的有机化工原料.
(1)乙烯通入到Br2水中,现象是_____________.
(2)由甲苯获取食品香料添加剂苯甲酸苯甲酯,存在下列转化:
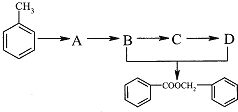
回答下列问题:
①C中的官能团名称____________,C→D的反应类型________________.
②B→C的化学方程式为________________.
③B+D→ ![]() 的化学方程式为_____________________.
的化学方程式为_____________________.
④A的化学式为C7H7Cl,则含有苯环的A的同分异构体还有______________种.
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化尿素的化学式为CO(NH2)2H2O2,是过氧化氢和尿素的加合物,外观为白色针状晶体,无毒无味,热分解温度为 45℃,易溶于水和乙醇,熔点 75-85℃,其水溶液兼有尿素和过氧化氢的性质,具有活性氧含量高、稳定性好等特点,被广泛用于医药、纺织领域。已知尿素与KMnO4溶液、NaOH 溶液都不反应。
I.合成过氧化尿素的流程及反应器的示意图如下:
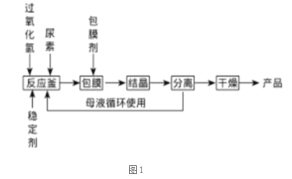
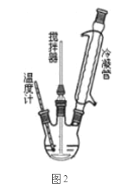
回答下列问题:
(1)图1中分离操作的名称为 _______,图 2 中反应器的名称是 _______;
(2)过氧化尿素是尿素分子与过氧化氢分子之间通过_________(填字母)结合形成的。
A.氢键 B.共价键 C.离子键 D.化学键
反应器中发生反应的化学方程式为____________。
(3)工业生产中,除向反应釜中投料反应物过氧化氢、工业尿素(含少量杂质铁、铜等离子)外,添加稳定剂可以提高产品的稳定性。不加稳定剂导致产品稳定率差的原因是 __。
(4)活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%)。为了确定所得产品合格与否,质检员称取干燥样品 2.500g,溶解于水,在250mL 容量瓶中定容,准确量取其中 25.00mL 溶液于锥形瓶中,加入1mL6mol/LH2SO4,然后用0.1000mol/L KMnO4标准溶液滴定样品中的H2O2,三次滴定平均消耗KMnO4溶液 8.000mL。
①达到滴定终点的现象是____________。
②根据滴定结果确定产品质量_(填“合格”或“不合格”),活性氧的质量分数为___。
II.过氧化尿素的性质探究:
(5)过氧化尿素的催化分解实验:在试管中加入 0.1g 产品、少量水及二氧化锰,用火柴余烬检验生成气体,可观察到火柴复燃。实验中加入二氧化锰的量一定要少(固体控制在小米粒大小)的原因是:_________。
(6)测定过氧化尿素溶液的酸碱性:在试管中加入1mL 6mol/L NaOH溶液、1mL过氧化尿素溶液和 2mL无水乙醇,振荡试管。测得pH约为6,并观察到有白色的胶状沉淀生成,该沉淀为生成的NaHO2在乙醇中析出。写出该反应的化学方程式:___
查看答案和解析>>
科目: 来源: 题型:
【题目】据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,其负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法正确的是
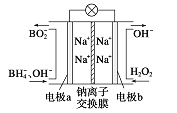
A. 该电池的负极反应为BH4-+8OH--8e-=BO2-+6H2O
B. 电池放电时Na+从b极区移向a极区
C. 每消耗3 mol H2O2,转移的电子为3 mol
D. 电极a采用MnO2作电极材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com