
科目: 来源: 题型:
【题目】一定质量的镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。下列关于反应的说法错误的是
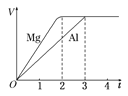
A.镁和铝的物质的量之比为3∶2
B.镁和铝转移电子数之比为1∶1
C.镁和铝的摩尔质量之比为8∶9
D.镁和铝反应所用时间之比为3∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】正丁醚常用作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:
2CH3CH2CH2CH2OH (CH3CH2CH2CH2)2O+H2O
(CH3CH2CH2CH2)2O+H2O
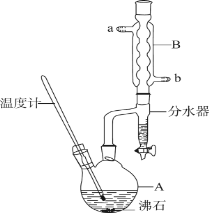
反应物和产物的相关数据如下:
相对分子质量 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
合成反应:
①将一定量的浓硫酸和正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
分离提纯:
③待A中液体冷却后将其缓慢倒入盛有一定量水的分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用蒸馏水、NaOH溶液和蒸馏水洗涤,分液后再加入一定质量的无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得正丁醚。
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为________。
(2)加热A前,需先从________(填“a”或“b”)口向B中通入水。
(3)步骤②中,若温度控制不当,最容易产生副产物的结构简式为________。
(4)分液漏斗在使用前须清洗干净并________,步骤③中粗产物应从分液漏斗的________(填“上”或“下”)口分离出。
(5)步骤④中加入NaOH溶液洗涤的目的为________。
(6)步骤⑤中,加热蒸馏时应收集________(填选项字母)左右的馏分。
a.100℃ b.117℃ C.135℃ d.142℃
(7)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分为________,下层液体的主要成分为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
① C![]() CO2
CO2![]() CO
CO![]() CO2
CO2
② Fe![]() Fe2O3
Fe2O3![]() Fe2(SO4)3
Fe2(SO4)3
③SO2![]() NH4HSO3
NH4HSO3![]() (NH4)2SO4
(NH4)2SO4
④AlCl3![]() Al
Al![]() NaAlO2
NaAlO2
⑤CuSO4(aq)![]() Cu(OH)2
Cu(OH)2![]() Cu2O
Cu2O
A.①②③B.①③⑤C.②③⑤D.③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:

(1)写出化学式:X_______,A________,B_______。
(2)实验室收集气体D和F的方法依次是_______法、________法。
(3)写出C→E的化学方程式:____________。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应与对应的图像相符合的是

A.I :N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
B.II : 2SO3(g) ![]() 2SO2(g)+O2(g)ΔH>0
2SO2(g)+O2(g)ΔH>0
C.III : 4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g)ΔH<0
4NO(g)+6H2O(g)ΔH<0
D.IV: H2(g)+CO(g) ![]() C(s)+H2O(g) ΔH>0
C(s)+H2O(g) ΔH>0
查看答案和解析>>
科目: 来源: 题型:
【题目】有一处于平衡状态的可逆反应:X(s)+3Y(g)![]() 2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
A.①③⑤B.②③⑤C.②③⑥D.②④⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】锂二次电池新正极材料的探索和研究对锂电池的发展非常关键。
(1) 锂硒电池具有优异的循环稳定性。
①正极材料Se可由SO2通入亚硒酸(H2SeO3)溶液反应制得,则该反应的化学方程式为__。
②一种锂硒电池放电时的工作原理如图1所示,写出正极的电极反应式:________________。充电时Li+向________(填“Se”或“Li”)极迁移。
③ Li2Sex与正极碳基体结合时的能量变化如图2所示,图中3种Li2Sex与碳基体的结合能力由大到小的顺序是________。
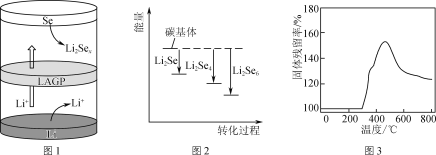
(2) Li2S电池的理论能量密度高,其正极材料为碳包裹的硫化锂(Li2S)。
① Li2S可由硫酸锂与壳聚糖高温下制得,其中壳聚糖的作用是________。
②取一定量Li2S样品在空气中加热,测得样品固体残留率随温度的变化如图3所示。(固体残留率=![]() ×100%)分析300 ℃后,固体残留率变化的原因是________。
×100%)分析300 ℃后,固体残留率变化的原因是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目: 来源: 题型:
【题目】在紫外线的作用下,氧气可生成臭氧:3O2![]() 2O3,一定条件下该反应达到平衡状态的标志是( )
2O3,一定条件下该反应达到平衡状态的标志是( )
A. 单位时间内生成2 mol O3,同时消耗3 mol O2
B. O2的消耗速率0.3 mol·L-1·s-1,O3的消耗速率0.2 mol·L-1·s-1
C. 容器内,2种气体O3、O2浓度相等
D. 气体密度不再改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com