
科目: 来源: 题型:
【题目】亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。
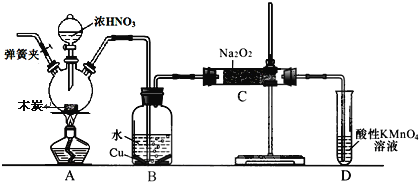
已知:室温下,①2NO+Na2O2→2NaNO2
②酸性条件下,NO 或![]() 都能与
都能与![]() 反应生成
反应生成![]() 和 Mn2+
和 Mn2+
③B 中的 Cu 足量
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式__________。
(2)检查完该装置的气密性,装入药品后,必须进行的一步操作是______________;
(3)D 装置的作用是 ________。
(4)经检验 C 产物中除亚硝酸钠外还含有副产物碳酸钠和_______,为避免产生这些副产物应在 B、C装置间增加装置 E,E 中盛放的药品名称________。
(5)将 7.8g 过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭_______________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019 年的化学诺贝尔奖颁给了为锂电池研究作出贡献的三位科学家,其研究的是两种常见锂电池:一种是采用镍钴锰酸锂Li(NiCoMn)O2或镍钴铝酸锂为正极的“三元材料锂电池”;另一种是采用磷酸铁锂(LiFePO4)为正极的电池。请回答下列问题:
(1)Mn位于元素周期表的_____区(填“s”或“p”或“d”或“ds”或“f”),基态钴原子的未成对电子数为_____,1mol [Co(NH3)5Cl]Cl2中含σ键数目为___ NA。
(2)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是______________。![]() 的空间构型是________________,HPO3中心原子的杂化方式是_________________。
的空间构型是________________,HPO3中心原子的杂化方式是_________________。
(3)PH3是_____分子(填“极性”或“非极性”),其在水中的溶解性比NH3小,原因是____。
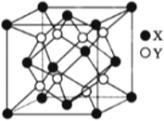
(4)硫化锂Li2S(摩尔质量Mgmol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如下图。S2-的配位数是______;若硫化锂晶体的密度为a g·cm -3,则距离最近的两个S2-的距离是_____nm。(用含 a、M、NA的计算式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁及其化合物在生产、生活中应用广泛。
(1)已知: ①3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) △H1=a kJ·mol-1;
②2H2(g)+O2(g)=2H2O(1) △H2=b kJ·mol-1
③H2O(g)=H2O(l) △H3=c kJ·mol-1
则3Fe(s)+2O2(g))=Fe3O4(s)△H=_________kJ·mol-1(用含 a、b、c 的代数式表示)。
(2)活性铁粉是合成氨气的催化剂。工业合成氨的原理为N2+3H2![]() 2NH3 △H<0
2NH3 △H<0
①工业采用“高压”一般为20~50MPa,温度为 500℃。采用“温度为 500℃”的目的是____________;
②氨气是合成氮肥的重要原料。常温下,0.1mol·L-1(NH4)2SO4溶液中离子浓度大小排序为___________;
③常温下,向a mL c mol·L-1氨水中滴加b mL c mol·L-1稀硝酸恰好至溶液pH=7(溶液体积变化忽略不计),则NH3·H2O的电离常数Kb=___;
(3)工业上用热还原法冶炼铁。在密闭容器中,投人足量的 FeO 粉末和炭粉,在一定温度下发生反应:FeO(s)+C(s)Fe(s)+CO(g) △H>0;
①若容积恒定,则下列情况表明上述反应达到平衡状态的是___________(填代号)
A.FeO 的浓度不再改变 B.气体相对分子质量不再改变 C.气体密度不再改变 D.铁粉的质量不再改变
②在该温度下,上述反应达到平衡时c(CO)=a mol·L-1,则该反应的平衡常数为________;在温度不变时,将容器体积扩大至原来的4倍,则达到新平衡时,c(CO)为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硼及其化合物生产中有广泛用途,硼和铝位于同主族,具有相类似的化学性质。
(1)硼和氯气反应生成 BCl3,在该分子中,硼原子最外层有__________个电子。
(2)硼与氢氧化钠溶液反应生成 Na[B(OH)4](四羟基合硼酸钠)和氢气,该反应的化学方程式为____________。
(3)B(OH)3(硼酸)是一元弱酸,它在水中类似氨的电离: NH3+H2O![]() +OH- ,硼酸在水中电离的方程式为____。
+OH- ,硼酸在水中电离的方程式为____。
(4)NaBH4 是有机合成中重要的还原剂。工业上合成方法之一是:Na2B4O7 +16Na+8H2 +7SiO2 ![]() 7Na2SiO3 +4NaBH4 ,在该反应中,氧化剂是___________,制备1 mol NaBH4时转移 ____________mol 电子。
7Na2SiO3 +4NaBH4 ,在该反应中,氧化剂是___________,制备1 mol NaBH4时转移 ____________mol 电子。
(5)NaBH4与水反应生成Na[B(OH)4]和一种气体,写出化学方程式:_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,下列说法正确的是
A.某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=a+1
B.在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液pH<7
C.NH4Cl溶液的Kw大于NaCl溶液的Kw
D.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中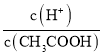 增大
增大
查看答案和解析>>
科目: 来源: 题型:
【题目】中医经典方剂组合对新冠肺炎病毒治疗具有良好的效果。其中的一味中药黄芩的有效成分结构简式如图所示,下列说法错误的是
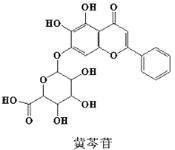
A.黄芩苷是芳香化合物,共含有四种官能团B.黄芩苷可发生取代、加成、氧化、还原反应
C.1mol 黄芩苷最多消耗 3molNaOHD.1 mol 黄芩苷最多与 7mol H2 发生反应
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素X、Y、Z、W 的原子序数依次增大,X、Y 为有机物中常见元素,Y、Z、W 同周期,由四种元素形成的化合物甲的结构如图。下列说法正确的是
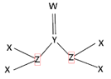
A.最高化合价:W>Z>Y>X
B.蛋白质中一定含有这四种元素
C.(YZ)2 与 X2W2 均为直线型分子
D.化合物甲的一种同分异构体可能既有离子键又有共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如下所示。
达到平衡,正反应速率随时间变化的示意图如下所示。

A. 反应在c 点达到平衡状态
B. 反应物浓度:![]() 点小于
点小于![]() 点
点
C. 反应物的总能量低于生成物的总能量
D. ![]() 时,SO2的转化率:
时,SO2的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2可转化成有机物实现碳循环。在容积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
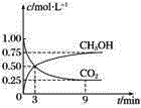
(1)从3 min到9 min,v(H2)=________ mol·L-1·min-1。
(2)能说明上述反应达到平衡状态的是________(填字母)。
A 反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B 混合气体的密度不随时间的变化而变化
C 单位时间内消耗3 mol H2,同时生成1 mol H2O
D CO2的体积分数在混合气体中保持不变
(3)一定温度下,第9 min时v逆(CH3OH)________(填“大于”“小于”或“等于”)第3 min时v正(CH3OH)。
查看答案和解析>>
科目: 来源: 题型:
【题目】钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+2I2(g)![]() WI4(g)。下列说法不正确的是
WI4(g)。下列说法不正确的是
A.灯管内的I2可循环使用
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
D.利用该反应可以提纯W
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com