
科目: 来源: 题型:
【题目】CO、NH3是工业生产中的常用气体,研究其在工业上的反应过程对提高生产效率尤为重要。
I.工业上用CO和H2做原料可以合成甲醇,作为液体燃料。已知:
① 2H2(g)+CO(g) +![]() O2(g) = 2H2O(g)+CO2(g) ΔH1= -594.1kJ/mol
O2(g) = 2H2O(g)+CO2(g) ΔH1= -594.1kJ/mol
② 2CH3OH(l)+3O2(g) = 4H2O(g)+2CO2(g) ΔH2 = -1452kJ/mol
(1)请写出用CO(g)和H2(g)合成1mol液态甲醇的热化学反应方程式:______________。
(2)一定温度下,在容积为2L的恒容容器中加入3mol H2和2mol CO,当反应2H2(g)+CO(g)![]() CH3OH(g)达到平衡时,测得容器内的压强是反应前压强的
CH3OH(g)达到平衡时,测得容器内的压强是反应前压强的![]() ,计算得该温度下反应的平衡常数K=____________。保持恒温恒容,向上述达到平衡的容器中再通入CO(g)和CH3OH(g),使得CO(g)和CH3OH(g)浓度均为原平衡的2倍,则平衡移动方向为________移动(填“正向”、“逆向”或“不”)。
,计算得该温度下反应的平衡常数K=____________。保持恒温恒容,向上述达到平衡的容器中再通入CO(g)和CH3OH(g),使得CO(g)和CH3OH(g)浓度均为原平衡的2倍,则平衡移动方向为________移动(填“正向”、“逆向”或“不”)。
II.对于氨的合成反应 N2(g)+3H2(g)![]() 2NH3(g) △H<0,在密闭容器内充入0.1mol/L N2和0.3 mol/L H2。反应中NH3的物质的量浓度的变化情况如下图,试回答问题:
2NH3(g) △H<0,在密闭容器内充入0.1mol/L N2和0.3 mol/L H2。反应中NH3的物质的量浓度的变化情况如下图,试回答问题:
(3)恒容条件下,从开始反应到建立起平衡状态,v(N2)=_________;反应达到平衡后,第5分
钟末只改变反应温度,保持其它条件不变,则改变条件后NH3的物质的量浓度不可能为_____。
A. 0.20 mol/L B. 0.12 mol/L C. 0.10 mol/L D. 0.08 mol/L
(4)在第5分钟时将容器的体积缩小一半,反应在第8分钟时达到新的平衡,此时NH3的浓度约为0.30 mol/L。请在上图中画出第5分钟之后的NH3浓度的变化曲线______。
(5)其它条件不变,若只把容器改为恒压容器,加入0.2 molN2和0.6 molH2,达到平衡时,NH3的体积分数为m%。若向容器中继续加入0.2 molN2和0.6 molH2,,在同样的温度下达到平衡时,NH3的体积分数为n%,则m和n的关系正确的是______。
A.m>n B.m<n C.m=n D.无法比较%
查看答案和解析>>
科目: 来源: 题型:
【题目】天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:C2H6(g)= C2H4(g)+H2(g) ΔH,相关物质的燃烧热数据如下表所示:
物质 | C2H6(g) | C2H4(g) | H2(g) |
燃烧热ΔH/( kJ·mol1) | -1560 | -1411 | -286 |
①ΔH=_________kJ·mol1。
②提高该反应平衡转化率的方法有_________、_________。
③容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kp=_________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)高温下,甲烷生成乙烷的反应如下:2CH4![]() C2H6+H2。反应在初期阶段的速率方程为:r=k×
C2H6+H2。反应在初期阶段的速率方程为:r=k×![]() ,其中k为反应速率常数。
,其中k为反应速率常数。
①设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=_____ r1。
②对于处于初期阶段的该反应,下列说法正确的是_________。
A.增加甲烷浓度,r增大 B.增加H2浓度,r增大
C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小
(3)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
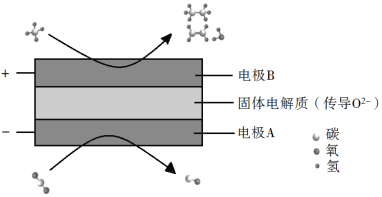
①阴极上的反应式为_________。
②若生成的乙烯和乙烷的体积比为2∶1,则消耗的CH4和CO2体积比为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组,在做Na2O2与水反应实验时,发现Na2O2与水反应后的溶液中滴加酚酞试液溶液呈现红色,但红色很快褪色,甲、乙、丙三同学对此现象分别做了如下推测:
甲:因为反应后试管很热,所以可能是溶液温度较高使红色褪去。
乙:因为所加水的量较少,红色褪去可能是生成的NaOH溶液浓度较大的影响。
丙:Na2O2具有强氧化性,生成物中O2、H2O(可能产物)等也具有强氧化性,氧化漂白了红色物质。
(1)验证甲同学的推测是否正确的方法是_________,验证乙同学的推测是否正确的方法是_________,当出现_________现象时,即说明丙同学的推测正确。
(2)有同学提出用定量的方法探究丙同学方案中是否含有出O2,其实验方法为:称取2.6g Na2O2固体,使之与足量的水反应,测量产生O2的体积,与理论值比较,即可得出结论。
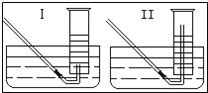
①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用上图装置中的_______,理由是________。
②若在标准状况下测量气体的体积,应选用量筒的大小规格为______(选填“l00mL”、“200mL”、“500mL”或“l000mL”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用下列装置检验Cl2的性质。
|
|
|
Ⅰ |
| Ⅲ |
(1)I图中退色的是______(填“a”或“b”),I图烧杯中发生反应的离子方程式是______。
(2)Ⅱ图中的现象是_________。
(3)将铜丝换成铁丝,做Ⅱ实验,结果也能点燃,你认为铁丝也能点燃的理由是_______(填选项字母)。
A Fe与Cu都是金属元素 B Fe的熔点比Cu高
C Fe的密度比Cu小 D Fe的性质比Cu活泼
(4)将Ⅲ装置放置在光亮的地方(日光没有直接照射),一会儿后,量筒内黄绿色气体颜色变浅,量筒内液面上升等。(混合气中氢气含量为60%),己知:氢气含量超过52.8%,光照不会发生爆炸)
①量筒中液面上升的原因是_________。
②水槽用饱和食盐水而不用水的原因是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如右图所示。下列结论不正确的是( )

A. 反应开始4 min内温度对反应速率的影响比浓度大
B. 一段时间后,反应速率减小的原因是c(H+)减小
C. 反应在2~4 min内平均反应速率最大
D. 反应在2~4 min内生成CO2的平均反应速率为v(CO2)=0.06 mol·L-1·s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知铁的相对原子质量是56 ,则1个铁原子的质量是_______g。(用NA表示)
(2)在标准状况下,1.7g氨气所占的体积为_______L,它与标准状况下_____L硫化氢含有相同数目的氢原子。
(3)已知CO、CO2的混合气体质量共16.0g,标准状况下体积为8.96L,则可推知该取混合气体中含CO____g,所含CO2在标袱状况下的体积为__________L。
(4)同温同压下同体积的H2和A气体的质量分别是0.2g和l.6g,则气体A的摩小质量为________,含有A的分子个数为________。(用NA表示)
(5)标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是_____mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许______离子通过,氯气的逸出口是_______(填标号)。
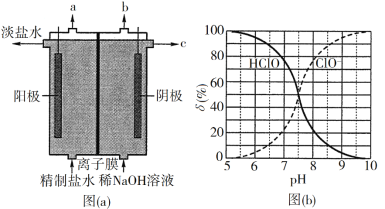
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)=![]() ,X为HClO或ClO]与pH的关系如图(b)所示。HClO的电离常数Ka值为______。
,X为HClO或ClO]与pH的关系如图(b)所示。HClO的电离常数Ka值为______。
(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为______。
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为_____mol;产生“气泡”的化学方程式为____________。
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是______(用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为____kg(保留整数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是
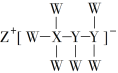
A.该化合物中,W、X、Y之间均为共价键
B.Z的单质既能与水反应,也可与甲醇反应
C.Y的最高化合价氧化物的水化物为强酸
D.X的氟化物XF3中原子均为8电子稳定结构
查看答案和解析>>
科目: 来源: 题型:
【题目】将0.1mol/L的K2SO4溶液、0.2mol/L的Al2(SO4)3溶液和纯水混合,要使混合液中K+ 、Al3+、 SO42-的浓度分别为0.1mol/L、0.1mol/L、0.2mol/L,则所取三者的体积比是(假定混合后的体积不变)( )
A.1:1:1 B.2:1:2 C.1:1:2 D.2:1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中不正确的是
A.常温常压下,28gCO与N2的混合气体所含有的原子数为2NA
B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14:1
C.同温同压下,相同质量的二氧化碳和二氧化硫的体积是16:11
D.常温常压下,0.5×6.02×1023一氧化碳分子所占体积是11.2L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com