
科目: 来源: 题型:
【题目】氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾,因此必须对含有氮氧化物的废气进行处理。
(1)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH=2NaNO2+H2O ①
2NO2+2NaOH=NaNO2+NaNO3+H2O ②
在反应①中,氧化剂是___,还原剂是___。在反应②中,氧化剂是__,还原剂是__。
(2)汽车尾气中含有二氧化氮和一氧化碳,消除这两种物质对大气污染的方法是安装催化转化器,使它们发生反应生成氮气和二氧化碳,该反应的化学方程式为___。
(3)氨气亦可用来处理氮氧化物。例如,氨气与二氧化氮发生如下反应:6NO2+8NH3=7N2+12H2O。若某工厂排出的尾气中二氧化氮含量为0.5%(体积分数),处理1×103m3(标准状况)这种尾气,需要多少千克氨气___?
查看答案和解析>>
科目: 来源: 题型:
【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液。 用0.100mol![]() L-1硫酸滴定,写出该中和反应的热化学方程式____________(中和热ΔH=-57.3 kJ/mol)。将该烧碱样品配成500mL待测溶液需要的玻璃仪器有_________________________。
L-1硫酸滴定,写出该中和反应的热化学方程式____________(中和热ΔH=-57.3 kJ/mol)。将该烧碱样品配成500mL待测溶液需要的玻璃仪器有_________________________。
(3)滴定过程中,眼睛应注视_________________,若用酚酞作指示剂达到滴定终点颜色变化是____________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是_____molL-1,烧碱样品的纯度是____(保留小数点后两位)
滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(5)下列实验操作会对滴定结果产生什么后果?(填“偏高”“偏低”或“无影响”)
① 观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果____。
② 若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2008年北京奥运会主体育场“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884 块ETFE 膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法正确的是

A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga 处于IIIA 族,可推知氮化镓化学式为GaN
C.用金属铝与V2O5反应冶炼钒,V2O5作还原剂
D.ETFE 膜(![]() )是由一种单体加聚而成的
)是由一种单体加聚而成的
查看答案和解析>>
科目: 来源: 题型:
【题目】维生素E是一种人体必需的脂溶性维生素,现已广泛应用于医药、营养品、化妆品等。天然的维生素E由多种生育酚组成,其中α-生育酚(化合物E)含量最高,生理活性也最高。下面是化合物E的一种合成路线,其中部分反应略去。
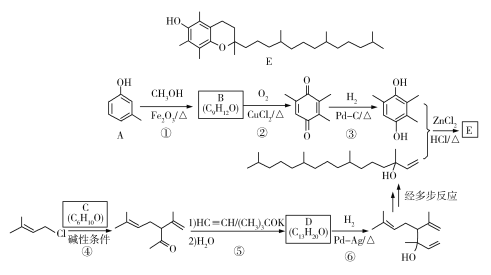
已知以下信息:a) 
b) 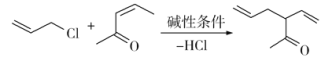
c) 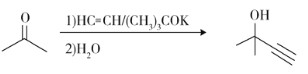
回答下列问题:
(1)A的化学名称为_____________。
(2)B的结构简式为______________。
(3)反应物C含有三个甲基,其结构简式为______________。
(4)反应⑤的反应类型为______________。
(5)反应⑥的化学方程式为______________。
(6)化合物C的同分异构体中能同时满足以下三个条件的有_________个(不考虑立体异构体,填标号)。
(ⅰ)含有两个甲基;(ⅱ)含有酮羰基(但不含C=C=O);(ⅲ)不含有环状结构。
(a)4 (b)6 (c)8 (d)10
其中,含有手性碳(注:连有四个不同的原子或基团的碳)的化合物的结构简式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】无色的混合气体甲,可能含NO、CO2、NO2、N2中的几种,将一定量的甲气体经过如图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )

A.NO2、N2B.NO、CO2
C.NO2、CO2D.NO、CO2、N2
查看答案和解析>>
科目: 来源: 题型:
【题目】甲同学发布了三份无色溶液检测报告,结果如下(水电离的H+、OH-忽略不计):
溶液(1)中所含全部离子及其浓度
离子 | 浓度mol/L | 离子 | 浓度mol/L |
Na+ | 0.1 | Cu2+ | 0.2 |
Ba2+ | 0.5 | NO3- | 1.5 |
Mg2+ | 0.3 | Cl- | 0.6 |
溶液(2)中所含全部离子及其浓度
离子 | 浓度mol/L | 离子 | 浓度mol/L |
Na+ | 0.1 | Cl- | 0.9 |
Ag+ | 0.5 | NO3- | 0.3 |
Mg2+ | 0.3 |
溶液(3)中所含全部离子及其浓度
离子 | 浓度mol/L | 离子 | 浓度mol/L |
Na+ | 0.1 | Cl- | 0.2 |
K+ | 0.5 | NO3- | 0.3 |
Mg2+ | 0.3 | SO42- | 0.4 |
试分析判断:上述三份检测结果是否可靠,若不可靠,说出理由。
I.溶液(1)结果是否可靠________,理由________。
溶液(2)结果是否可靠_________,理由________。
溶液(3)结果是否可靠_________,理由________。
II.乙同学对可能含有下列6种离子的溶液进行如下实验:Cl-,SO42-,NH4+,CO32-,K+,Na+;
已知:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
a.取200mL上述溶液,向其中加入足量BaCl2溶液,反应后将沉淀过滤,洗涤,干燥,得沉淀4.30g,向沉淀中加入足量的盐酸,有2.33g沉淀不溶。
b.向a的滤液中加入足量的NaOH溶液,加热,产生标况下的气体1.12L(假定气体全部逸出 )
(1)溶液中一定存在的离子有_____,可能存在的离子有_____。
(2)原溶液中![]() ___
___![]() ,
,![]() ___
___![]() (填“>”“<”“=”,下同)
(填“>”“<”“=”,下同)
(3)如果上述6种离子都存在,则![]() ____
____![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要配制0.50mol/LNaCl溶液480mL,现使用NaCl固体配制,按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、______、_______以及等质量的两片纸片。
(2)计算。配制该溶液需取NaCl晶体_______g。
(3)配置过程。
①天平调零。
②称量过程中NaCl晶体应放于天平的_______(填“左盘”或“右盘”)。
③称量完毕,将药品倒入烧杯中。
④溶解、冷却,该步实验中需要使用玻璃棒,目的是________。
⑤转移、洗涤。在转移时应使用_____引流,需要洗涤烧杯2-3次是为了______。
⑥定容、摇匀。
⑦将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、溶液名称及浓度。
(4)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会______(填“高”、“偏低”或“无影响”)。
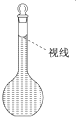
查看答案和解析>>
科目: 来源: 题型:
【题目】苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
![]() +KMnO4→
+KMnO4→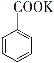 + MnO2
+ MnO2 +HCl→
+HCl→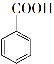 +KCl
+KCl
名称 | 相对分 子质量 | 熔点/℃ | 沸点/℃ | 密度/(g·mL1) | 溶解性 |
甲苯 | 92 | 95 | 110.6 | 0.867 | 不溶于水,易溶于乙醇 |
苯甲酸 | 122 | 122.4(100℃左右开始升华) | 248 | —— | 微溶于冷水,易溶于乙醇、热水 |
实验步骤:
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g(约0.03 mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0 g。
(3)纯度测定:称取0. 122 g粗产品,配成乙醇溶液,于100 mL容量瓶中定容。每次移取25. 00 mL溶液,用0.01000 mol·L1的KOH标准溶液滴定,三次滴定平均消耗21. 50 mL的KOH标准溶液。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为______(填标号)。
A.100 mL B.250 mL C.500 mL D.1000 mL
(2)在反应装置中应选用______冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是______。
(3)加入适量饱和亚硫酸氢钠溶液的目的是___________;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理__________。
(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是_______。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是_______。
(6)本实验制备的苯甲酸的纯度为_______;据此估算本实验中苯甲酸的产率最接近于_______(填标号)。
A.70% B.60% C.50% D.40%
(7)若要得到纯度更高的苯甲酸,可通过在水中__________的方法提纯。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。放电时总反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
① 写出放电时负极的电极反应式:______________________________;
② 铅蓄电池放电时,溶液的pH将_________(填增大、减小或不变)。当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为___________。
③ 放电完后,对该电池进行充电,在连接电源的负极一端生成________。(填“Pb”或“PbO2”)
(2)下图是某宇宙飞船中使用的氢氧燃料电池。其导电介质为KOH,总反应为:2H2 + O2=2H2O。
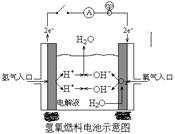
① 则负极通入的是_______,(填“H2”或“O2”)负极电极反应式为:_______________________,正极电极反应式为:______________________。
②如把导电介质改为稀H2SO4,则电极反应式为:负极__________________,正极______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为____________。
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是____________。
化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
熔点/℃ | 377 | ﹣24.12 | 38.3 | 155 |
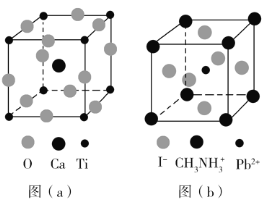
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是__________;金属离子与氧离子间的作用力为__________,Ca2+的配位数是__________。
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I﹣和有机碱离子![]() ,其晶胞如图(b)所示。其中Pb2+与图(a)中__________的空间位置相同,有机碱
,其晶胞如图(b)所示。其中Pb2+与图(a)中__________的空间位置相同,有机碱![]() 中,N原子的杂化轨道类型是__________;若晶胞参数为a nm,则晶体密度为_________g·cm-3(列出计算式)。
中,N原子的杂化轨道类型是__________;若晶胞参数为a nm,则晶体密度为_________g·cm-3(列出计算式)。
(5)用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图(c)所示,用离子方程式表示该原理_______、_______。
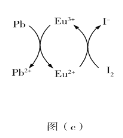
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com