
科目: 来源: 题型:
【题目】用![]() 表示原子:
表示原子:
(1)中性原子的中子数:N=________。
(2)阳离子的中子数:![]() 共有x个电子,则N=________。
共有x个电子,则N=________。
(3)阴离子的中子数:![]() 共有x个电子,则N=________。
共有x个电子,则N=________。
(4)中性分子或原子团的中子数:![]() 分子中,N=________。
分子中,N=________。
(5)A2-原子核内有x个中子,其质量数为m,则ng A2-所含电子的物质的量为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断。
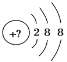
(1)该微粒是中性微粒,这种微粒的符号是________。
(2)该微粒的盐溶液能使溴水褪色,并出现浑浊,这种微粒的符号是________。
(3)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,这种微粒的符号是________。
(4)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,这种微粒的符号是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】芳香族化合物 E 是合成某种香料的中间体 ,以苯为原料合成 E 流程如下 :
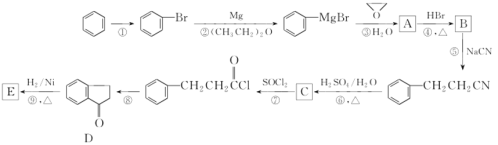
已知:CH3Br![]() CH3 MgBr
CH3 MgBr 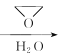 CH3CH 2CH2OH;
CH3CH 2CH2OH;
![]()
![]()
![]()
(1)写出反应①所需的试剂和条件______;
(2)化合物A中碳原子的杂化类型为_____, 分子中不同化学环境的氢原子共有___种;
(3)D中含氧官能团的名称为______;
(4)写出反应⑨的化学方程式_____,该反应的反应类型为_____;
(5)化合物C能与Na2CO3溶液反应生成CO2,符合以下 a 、b 、c、d条件的C的同分异构体与足量NaOH溶液反应的化学方程式___;
a.属于芳香族化合物 b.能发生银镜反应,也能发生水解反应 c. 结构中存在乙基 d苯环上的一氯代物只有 2 种
(6)以![]() 为主要原料,合成
为主要原料,合成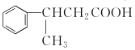 的流程为_________。
的流程为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硼氢化钠(NaBH4)是常用的还原剂,用途广泛。某探究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:
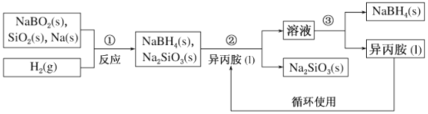
已知:NaBH4常温下易与水反应,可溶于异丙胺(沸点:33℃)
(1)在第①步反应加料之前,需要将反应器加热至 100 ℃以上并通入氩气 ,该操作的目的是______;第②步分离采用的方法是______;第③步分离NaBH4并回收溶剂,采用的方法是_____;
(2)NaBH4与水反应生成H2 : NaBH4 + 2H2O=NaBO2+4H2↑ (已知:HBO2是弱酸)。 实验测得,NaBH4每消耗一半所用的时间与溶液 pH、温度的关系如下表:
pH | 8 | 10 | 12 | 1 4 |
温度/℃ | 25 | 25 | 25 | 25 |
时间/ min | 6. 2 ×10-1 | 6. 2 ×10 | 6. 2 ×103 | 6. 2 ×105 |
①NaBH4与水反应开始释放H2很快 ,经过一段时间后就缓慢下来 ,可能原因一是反应物浓度降低 ;二是________;
②为了加快制取的H2速率,常将一些促进剂投入水中,下列物质中可作为促进剂的是__;
a. 碳酸钾 b. 稀硝酸 c 硫酸氢钠 d. 氨水
(3)利用如图所示装置,可以测定NaBH4与水反应生成 H2的速率,在pH =10、25℃条件下,将恒压滴液漏斗中NaBH4滴加到含有催化剂的三颈烧瓶中。
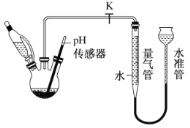
①实验中使用恒压滴液漏斗的原因为_________;
②气体生成结束后,水准管中的液面会高于量气管中的液面,此时量气管读数会_____( 填“偏大”或“偏小”)需要将水准管慢慢向下移动,则量气管中的液面会__________(填“上升”或“下降”);
③在此条件下,0. 38 g NaBH4开始反应至剩余 0. 19 g 时,实验测得量气管内气体体积为124mL,则这段时间内,生成H2的平均速率是_______mL·min-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】丙烷在燃烧时放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知: 2C3H8(g)+7O2(g)=6CO(g)+8H2O(1) △H1 =-2741.8 kJmol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0 kJmol-1
(1)反应C3H8 (g)+5O2(g)=3CO2(g)+4H2O(l) △H=____________;
(2)现有1molC3H8在不足量的氧气里燃烧,生成1molCO和2molCO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g)CO2(g)+H2(g) △H=+41.2kJmol-1
①下列事实能说明该反应达到平衡的是_____________;
a.体系中的压强不再变化 b.v正( H2) = v逆( CO ) c.混合气体的平均相对分子质量不再变化 d.CO2 的浓度不再发生变化
②5min 后体系达到平衡,经测定,容器中含 0.8 mol H2,则平衡常数K =______;
③其他条件不变,向平衡体系中充入少量CO,则平衡常数K______(填“增大”、“减小”或“不变”)
(3)根据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体 ;燃料电池内部是熔融的掺杂着氧化钆(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-,在电池内部O2-向______极移动(填“正”或“负”);电池的负极电极反应为________。
(4)用上述燃料电池和惰性电极电解足量Mg(NO3)2和NaCl的混合溶液,电解开始后阴极附近的现象为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某微粒A的结构示意图为![]()
(1)若A是原子,则A的元素符号为__;若A是带一个正电荷的阳离子,则X=___
(2)若X=8,则此阴离子与(1)中带一个正电荷的阳离子形成一种常见化合物的化学式是___,它是不是电解质(填是或否)____。写出此化合物与盐酸反应的化学方程式:________________________________
(3)1mol微粒A含有10mol电子,下列微粒各1mol,也含有10mol电子的有:___(填序号)
①CH4 ②H2O2 ③HF ④Al3+ ⑤Cl- ⑥NH4+
(4)若A的阳离子为An+且质量数为a,则其质子数为____________,中子数为_______________(用含有a,n的代数式表达)
查看答案和解析>>
科目: 来源: 题型:
【题目】饮用水中含有砷会导致砷中毒,金属冶炼过程产生的含砷有毒废弃物需处理与检测。冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:①As2S3与过量的S2-存在反应:As2S3(s)+3S2-(aq)2![]() (aq);
(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)砷在元素周期表中的位置为_______;AsH3的电子式为______;
(2)下列说法正确的是_________;
a.酸性:H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.第一电离能:S<P<As
(3)沉淀X为__________(填化学式);
(4)“一级沉砷”中FeSO4的作用是________。
(5)“二级沉砷”中H2O2与含砷物质反应的化学方程式为__________;
(6)关于地下水中砷的来源有多种假设,其中一种认为富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成![]() ,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______________。
,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒容密闭容器中将CO2与含少量CO的H2混合生成甲醇,反应为:CO2(g)+3H2(g)CH3OH(g)+H2O(g),下图表示按![]() 分别为①1:4和②1:6两种投料比时,CO2的平衡经随温度变化的曲线。
分别为①1:4和②1:6两种投料比时,CO2的平衡经随温度变化的曲线。
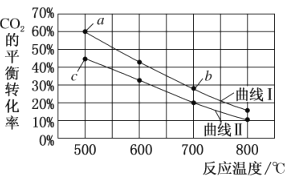
设①②两种投料比时CO2投料的物质的量浓度相等。下列有关说法正确的是
A.按投料比①时,CO2的平衡转化率随温度变化的曲线对应的是图中的曲线l
B.图中a点对应的H2的转化率为30%
C.图中b点对应的平衡常数K的值大于c点
D.![]() 的数值,a点比c点小
的数值,a点比c点小
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出表示含有8个质子,10个中子的原子的化学符号:________。
(2)根据下列微粒回答问题:![]() H、
H、![]() H、
H、![]() H、
H、![]() C、
C、![]() 、
、![]() 、
、![]() 、
、![]() 。
。
①以上8种微粒共有________种核素,共________种元素。
②互为同位素的是________。
③质量数相等的是________和________,中子数相等的是________和________。
(3)相同物质的量的![]() 与
与![]() 的质量之比为________;中子数之比为________;电子数之比为________。
的质量之比为________;中子数之比为________;电子数之比为________。
(4)铷和另一种碱金属形成的合金7.8g与足量的水反应后,产生0.2g氢气,则此合金中另一碱金属可能是______________。(铷的相对原子质量取85.5)
(5)质量相同的H2O和D2O与足量钠反应,放出的气体在标准状况下的体积之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com