
科目: 来源: 题型:
【题目】常见的电子气体有BCl3、N2O、SiH4及SiHCl3等。回答下列问题:
(1)气体B2H6与氯气混合可生成气态BCl3,每生成1.0 g BCl3放出5.9 kJ的热量,该反应的热化学方程式为______。
(2)25℃时反应 S(s) +H2(g)H2S(g) Kp1=6.0×105
Si(s)+2H2(g)SiH4(g) Kp2=7.8×106
则反应 Si(s)+2H2S(g)SiH4(g)+2S(s) Kp=_____(Kp为以分压表示的平衡常数,下同)。
(3)多晶硅制中发生一系列反应:
(I)4SiHCl3(g)Si(s)+3SiCl4(g)+2H2(g) △H1=a kJ /mol
(II)SiCl4(g)+H2(g)SiHCl3(g)+HCl(g) △H2=b kJ/mo1
(III)SiCl2(g)+H2(g)Si(s)+2HCl(g) △H3=c kJ/mo1
①反应SiHCl3 (g)SiCl2 (g) +HCl (g) △H=____kJ/mo1 (用含a、b、c的代数式表示)
②反应(I)(II)(III)的Kp与温度的关系如下图

属于吸热反应的是_________(填I、II或III);图中M点分压间满足关系:p(SiCl4)=______(用相关物质的分压p表示)。
(4)一种制取N2O的方法为 O2NNH2(aq)→N2O(g)+H2O(1),该反应的历程如下:
(I)O2NNH2(aq)![]() O2NNH-(aq) +H+(aq) (快速平衡)
O2NNH-(aq) +H+(aq) (快速平衡)
(II)O2NNH-(aq)![]() N2O(g) +OH-(aq) (慢)
N2O(g) +OH-(aq) (慢)
(III)H+(aq)+OH-(aq)![]() H2O(1) (快)
H2O(1) (快)
①活化能最大的反应步骤是_________(填I、II或III)。
②已知反应(I)的速率方程v(正)=k1c(O2NNH2),v(逆)=k -1 c(O2NNH-)c(H+),(k1、k -1分别为正逆反应速率常数,反应(I)达到平衡时,平衡常数K=__________(用k1、k -1表示)。
③已知总反应速率方程为v=K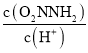 ,反应(II)的v(正)=k2c(O2NNH-),则K=________ (用k1、k -1、k2、k3表示)
,反应(II)的v(正)=k2c(O2NNH-),则K=________ (用k1、k -1、k2、k3表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】硫脲(![]() )是一种白色而有光泽的晶体,味苦,可用于制造树脂,也用作橡胶的硫化促进剂以及金属矿物的浮选剂等。回答下列问题:
)是一种白色而有光泽的晶体,味苦,可用于制造树脂,也用作橡胶的硫化促进剂以及金属矿物的浮选剂等。回答下列问题:
(1)硫脲中硫的化合价为_______;与硫脲互为同分异构且能与FeCl3溶液发生显色反应的化合物的化学式为_______
(2)可用H2NCN(氨基腈)与C2H5SH (乙硫醇)反应制备硫脲。氨基腈的电子式为_____
(3)制取氨基腈的传统工艺流程如下:
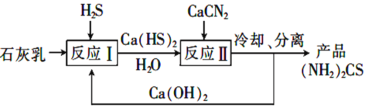
①反应Ⅱ的化学方程式为______
②测定硫脲含量的方法如下:
步骤1 :准确称取a g产品,经溶解等步骤最后在500 mL容量瓶中定容。
步骤2:准确量取20.00 mL配制好的溶液注入碘量瓶中,加入V1 mL c1 mol/L I2的标
准溶液及适量的NaOH溶液,于暗处放置10 min(2NaOH+I2=NaIO+NaI+H2O,
4NaIO+(NH2)2CS+H2O =(NH2)2CO+4NaI+H2SO2)。
步骤3:加水及适量的盐酸,摇匀。
步骤4:用c2 mol/L标准Na2S2O2溶液滴定剩余的I2( I2+2Na2S2O2=2NaI+Na2S4O6) ,加入淀粉溶液,滴定至终点时消耗Na2S2O2溶液V2mL。
“步骤3”加入盐酸的目的_________(用离子方程式说明)。
“步骤4”滴定至终点时的颜色变化是________。
③产品中(NH2)2CS的质量分数为_______ (列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,用 0.100 mol /L 盐酸滴定 20.00 mL 0.100 mol/L的CH3COONH4溶液,滴定曲线如下图所示,下列说法正确的是( )

A.可用酚酞作滴定指示剂
B.滴定过程中水的电离程度不断增大
C.P点溶液中:2c(![]() )<3c(CH3COO-)+c(CH3COOH)
)<3c(CH3COO-)+c(CH3COOH)
D.Q点溶液中:c(Cl-)>c(![]() )>c(CH3COO-)>c(H+)
)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)画出下列元素的原子结构示意图。
①核电荷数为13的元素:__________。
②某元素原子的最外层电子数等于次外层电子数:__________________ 。
③L 层电子数是M层电子数2倍的元素: ___________________ 。
④某同位素原子核内没有中子的元素: ___________________ 。
(2)写出1~18号元素中符合下列条件的原子(离子)的微粒符号和结构示意图。
①某元素原子L层上的电子数为K层的3倍: __________________ 。
②某元素原子L层上的电子数为K层的一半: _________________ 。
③得到2个电子后,电子总数与氩原子的电子总数相同的离子: ___________________ 。
④某元素原子的最外层电子数等于次外层电子数的2倍: ___________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】方铅矿(PbS)与黄铁矿(FeS2)两矿法酸溶铅的示意图如下,下列说法错误的是( )
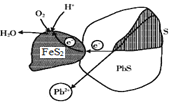
A.PbS上的电势比FeS2上的低
B.浸取液的pH随反应的进行逐渐增大
C.PbS表面发生的反应为PbS-2e-=Pb2++ S
D.FeS2表面发生的反应为FeS2+2e-=Fe2++ 2S2-
查看答案和解析>>
科目: 来源: 题型:
【题目】酸性重铬酸盐溶液中加入乙醚和H2O2发生反应![]() +4H2O2+2H+=2CrO(O2)2+5H2O。上层出现蓝色,一段时间后上层蓝色逐渐褪去且水相变为绿色(Cr3+)。下列说法错误的是( )
+4H2O2+2H+=2CrO(O2)2+5H2O。上层出现蓝色,一段时间后上层蓝色逐渐褪去且水相变为绿色(Cr3+)。下列说法错误的是( )
A.溶液出现蓝色的反应属于非氧化还原反应
B.乙醚可用乙醇代替
C.该方法既可用于检验H2O2,又可用于检验![]()
D.水层逐渐变为绿色发生的离子反应为4CrO(O2)2+ 12H+=4Cr3++ 6H2O+7O2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列描述中正确的是( )
A. 氮原子的价电子排布图:![]()
B. 2p和3p轨道形状均为哑铃形,能量也相等
C. 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
D. 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出表示含有8个质子,10个中子的原子的化学符号:______;
(2)最外层电子数为次外层电子数![]() 的原子______或______;(填元素符号)
的原子______或______;(填元素符号)
(3)根据下列微粒回答问题:
![]() H、
H、![]() H、
H、![]() H、
H、![]() C、
C、![]() 、
、![]() 、
、![]() 、
、![]()
①以上8种微粒共有______种核素,共______种元素.
②互为同位素的是______.
③质量数相等的是______和______,中子数相等的是______和______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com