
科目: 来源: 题型:
【题目】t℃时,卤化银(AgX,X=Cl,Br)的2条溶解平衡曲线如图所示,已知AgCl,AgBr的Ksp依次减小,且p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是
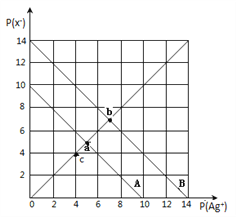
A. t℃时,c点可表示AgCl的不饱和溶液
B. B线表示的是AgBr
C. 取a、b两点处溶液等体积混合,维持t℃不变,混合溶液中一定无白色沉淀生成
D. 在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K≈104
AgBr(s)+Cl-(aq)平衡常数K≈104
查看答案和解析>>
科目: 来源: 题型:
【题目】有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生。第二份加足量NaOH溶液加热后,收集到0.08mol气体。第三份加足量BaCl2溶液后,得到干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl-。__。
(2)由第二份进行的实验得知混合物中应含有__,其物质的量浓度为__。
(3)由第三份进行的实验可知12.54g沉淀的成分及物质的量是__。
(4)综合上述实验,你认为以下结论正确的是__。
A.该混合液中一定含有K+、NH4+![]() 、CO32-、SO42-,可能含Cl-,且n(K+)≥0.04mol
、CO32-、SO42-,可能含Cl-,且n(K+)≥0.04mol
B.该混合液中一定含有NH4+、CO32-、SO42-,可能含K+、Cl-
C.该混合液中一定含有NH4+、CO32-、SO42-,可能含Mg2+、K+、Cl-
D.该混合液中一定含有NH4+、SO42-,可能含Mg2+、K+、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B两种常见金属元素的相对原子质量之比是8∶9。将两种金属单质按物质的量之比为3∶2组成1.26g混合物。将此混合物与足量稀硫酸反应,放出1.344L(标准状况)氢气。若这两种金属单质在反应中生成氢气的物质的量相等,求A、B两金属的摩尔质量各为多少___?
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物W是一种药物的中间体,一种合成路线如图:

已知:①![]() +
+![]()
![]()
![]()
②![]()
![]()
![]() +
+![]()
③![]()
![]()
![]()
请回答下列问题:
(1)A的系统命名为__。
(2)反应②的反应类型是__。
(3)反应⑥所需试剂和条件为__。
(4)写出反应③的化学方程式为__。
(5)写出F的结构简式:__。
(6)化合物M是D的同分异构体,则符合下列条件的M共有__种(不含立体异构)。
①1molM与足量的NaHCO3溶液反应,生成二氧化碳气体22.4L(标准状态下);
②0.5molM与足量银氨溶液反应,生成108gAg固体
其中核磁共振氢谱为4组峰且峰面积比为6∶2∶1∶1的结构简式为__(写出其中一种)。
(7)参照上述合成路线,以C2H5OH和![]() 为起始原料,选用必要的无机试剂合成
为起始原料,选用必要的无机试剂合成![]() ,写出合成路线__。
,写出合成路线__。
查看答案和解析>>
科目: 来源: 题型:
【题目】钴的化合物在工业生产、生命科技等行业有重要应用。
(1)Co的价电子排布式为__,的I4(Co)__的I4(Fe)(填>、<或者=),原因是__。
(2)Fe、Co均能与CO形成配合物,如Fe(CO)5、Co2(CO)8的结构如图1、图2所示,图1中0.1molFe(CO)5含有配位键__个,写出2个与CO互为等电子体微粒__,图2中的σ键和π键个数之比是__(填元素符号)。
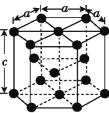
(3)金属钴的堆积方式为六方最密堆积,其配位数是__;该晶胞的边长为xnm,高为ynm,该晶胞的密度为__g·cm-3。(NA表示阿伏加德罗常数的值,列出代数式)
查看答案和解析>>
科目: 来源: 题型:
【题目】食品防腐剂R的结构简式如图所示: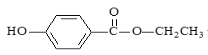 ,下列说法正确的是
,下列说法正确的是
A.R在空气中易被氧化且易溶于水
B.1个R分子最多有20个原子共平面
C.能与FeCl3发生显色反应,苯环有2个取代基,且能发生水解反应R的同分异构体有18种(包括R)
D.1molR与3molH2反应生成的有机物分子式为C9H18O3
查看答案和解析>>
科目: 来源: 题型:
【题目】CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如SO2,SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++SO42-
2CuCl↓+4H++SO42-
2CuCl2+SnCl2=2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:
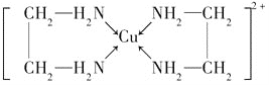
请回答下列问题:
(1)基态Cu原子的核外电子排布式为_________;H、N、O三种元素的电负性由大到小的顺序是_____________
(2)SO2分子的空间构型为_____________
(3)乙二胺分子中氮原子轨道的杂化类型为_________乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是_____________
(4)②中所形成的配离子中含有的化学键类型有______(填字母)。
A.配位键 B.极性键 C.离子键 D.非极性键
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,密闭容器中的H2在催化剂的催化下可高效转化酸性溶液中的硝态氮(![]() )以达到消除污染的目的。其工作原理的示意图如图:
)以达到消除污染的目的。其工作原理的示意图如图:
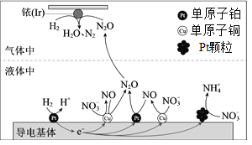
下列说法正确的是
A.导电基体上的正极产物仅有NO和![]()
B.若导电基体上的Pt颗粒增多,不利于降低溶液中的含氮量
C.若导电基体上只有单原子铜,![]() 能全部转化为N2O
能全部转化为N2O
D.若Ir的表面处理1molN2O,理论上负极消耗89.6LH2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 把100 mL 3 mol·L-1的H2SO4跟100 mL H2O混合,硫酸的物质的量浓度为1.5 mol·L-1
B. 把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10%
C. 把200 mL 3 mol·L-1的BaCl2溶液跟100 mL 3 mol·L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol·L-1
D. 把100 mL 20%的NaOH溶液跟100 mL H2O混合后,NaOH溶液的质量分数是10%
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是________(填字母)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备:
①甲同学的操作:取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。请评价该操作是否正确______。
②乙直接加热饱和FeCl3溶液,请评价是否正确______。
③丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟,请评价是否正确________。
(3)写出制备Fe(OH)3胶体的化学方程式: ____________________。证明有Fe(OH)3胶体生成的实验操作是_____________________。该操作利用胶体的性质是________。
(4)Fe(OH)3胶体稳定存在的主要原因是____________________(填字母,下同)。
A.胶体粒子直径小于1nm B.胶体粒子带正电荷
C.胶体粒子作布朗运动 D.胶体粒子能透过滤纸
(5)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________。
A.Fe(OH)3胶体粒子的直径在1~100 nm之间
B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
(6)若取少量制得的胶体加入试管中,加入硫酸铵溶液,现象是_____________,这种现象称为胶体的________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com