
科目: 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为________________g·cm-3(列出计算式)。

查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活、社会密切相关,下列说法正确的是 ( )
A.通信光缆的主要成分是晶体Si,太阳能电池的材料主要是SiO2
B.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,都利用了强氧化性
C.“光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关
D.以“地沟油”为原料生产的生物柴油与以“石油”为原料生产的柴油化学成分相似
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋资源的利用具有广阔前景。
(1)下列不属于海水淡化的方法________(填序号)。
A.蒸馏法 B.离子交换法
C.过滤法 D.电渗析法
(2)如图是从海水中提取镁的简单流程。
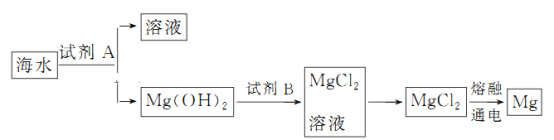
①试剂B是________(填化学式)。
②由无水MgCl2制取Mg的化学方程式是__________________________________________
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
海带![]() 海带灰
海带灰![]() 海带灰悬浊液
海带灰悬浊液![]() 含I-溶液
含I-溶液![]() 含I2水溶液
含I2水溶液![]() 含I2苯溶液
含I2苯溶液![]() 单质I2
单质I2
Ⅰ.下列不属于步骤①操作所用的仪器是________(填序号)。
A.酒精灯 B.漏斗
C.坩埚 D.泥三角
Ⅱ.步骤③的实验操作名称是________。
Ⅲ.④步骤反应的离子方程式____________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)从原子结构角度分析,D、E、G、I四种元素处于同一行,是由于它们的_______相同。E和F元素在周期表处于同一列是由于它们的______相同。
(2)E元素的最低化合价为___________,原子半径:r(E)_________ r(D)![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ,离子半径:r(G)_________ r(C)(填“
,离子半径:r(G)_________ r(C)(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)。
”)。
(3)在表中所列元素中最高价氧化物对应水化物中酸性最强的是________(写化学式)。
(4)科学家通过对某些元素的化合物进行研究,寻找高效农药。这些元素往往位于元素周期表的 _____________(选填序号)。
a.左下角区域 b.右上角区域 c.左上角区域 d.右下角区域
查看答案和解析>>
科目: 来源: 题型:
【题目】对于放热反应Zn+H2SO4===ZnSO4+H2↑,下列叙述正确的是( )
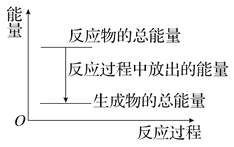
A. 反应过程中的能量关系可用上图表示
B. 1 mol Zn的能量大于1 mol H2的能量
C. 若将其设计为原电池,则锌作正极
D. 若将其设计为原电池,当有32.5 g Zn溶解时,正极放出的气体一定为11.2 L
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学课外活动小组为了验证元素非金属性递变规律,设计了如图所示的两套实验方案进行实验探究:
(1)根据方案一装置![]() 如图
如图![]() 回答以下问题:
回答以下问题:
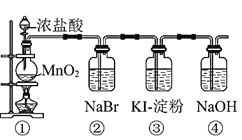
Ⅰ![]() 写出装置①中发生反应的化学方程式:______。
写出装置①中发生反应的化学方程式:______。
Ⅱ![]() 若将反应后②中的溶液倒入
若将反应后②中的溶液倒入![]() 中,出现的现象与图中吻合的是______。
中,出现的现象与图中吻合的是______。![]() 填代号
填代号![]()
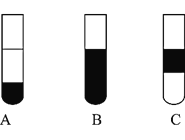
Ⅲ![]() 装置③中的现象是______。
装置③中的现象是______。
(2)根据方案二装置![]() 如图
如图![]() 回答以下问题:
回答以下问题:

Ⅰ![]() 方案二验证元素非金属性递变的理论依据是:______。
方案二验证元素非金属性递变的理论依据是:______。
Ⅱ![]() 装置的作用是______,X是______。
装置的作用是______,X是______。
Ⅲ![]() 能说明碳元素与硅元素非金属性强弱的实验现象是______。
能说明碳元素与硅元素非金属性强弱的实验现象是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素的核内质子数之和为56,在元素周期表中的位置如图所示,1 mol E的单质可与足量酸反应,能产生33.6 L H2(在标准状况下);E的阳离子与A的阴离子核外电子层结构相同。
A | ||
B | C | D |
回答下列问题:
(1)写出下列元素名称A__________,B___________,E____________
(2)C的简单离子结构示意图为_____________
(3)B单质在A单质中燃烧,反应现象是__________________________________,生成物的化学式为___________
(4)A与E形成的化合物的化学式为__________,它的性质决定了它在物质的分类中应属于__________________
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是_______________________,写出有关化学反应方程式______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲酸是基本有机化工原料之一,广泛用于农药、皮革、染料、医药和橡胶等工业。
(1)工业上利用甲酸的能量关系转换图如图:

反应![]() 的焓变
的焓变![]() ________
________![]() 。
。
(2)某科学小组研究不同压强条件对反应![]() 的影响。
的影响。![]() 下,在一个容积可变的密闭容器中,充入一定量的
下,在一个容积可变的密闭容器中,充入一定量的![]() 和
和![]() ,测得不同压强下,平衡时容器内气体的浓度如下表:
,测得不同压强下,平衡时容器内气体的浓度如下表:
试验编号 | 反应压强 | 物质浓度 | ||
|
|
| ||
1 |
| 0.3 | 0.3 | 0.9 |
2 |
|
|
| 0.4 |
3 |
| 0.4 | 0.4 |
|
试回答以下问题:
①平衡时,实验1的正反应速率________(填“>”、“<”或“=”)实验3的逆反应速率。
②由实验1的数据可计算![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() ________。
________。
③![]() ________
________![]() 。
。
(3)经研究发现采用电还原法也可将![]() 转化为甲酸根,同时还能提高
转化为甲酸根,同时还能提高![]() 的转换效率。其电解原理如图所示,下列叙述正确的是________。
的转换效率。其电解原理如图所示,下列叙述正确的是________。
A.![]() 极的电极反应式为
极的电极反应式为![]()
B.电解过程中![]() 向
向![]() 极移动
极移动
C.![]() 极发生还原反应并有气体逸出
极发生还原反应并有气体逸出
D.电解过程中![]() 浓度逐渐减小
浓度逐渐减小
(4)甲酸的用途之一是用于配制“缓冲溶液”,在这种溶液中加入少量的强酸蚀碱,溶液的![]() 变化不大,能保持溶液
变化不大,能保持溶液![]() 相对稳定。(已知甲酸的电离平衡常数
相对稳定。(已知甲酸的电离平衡常数![]() )
)
①现将等浓度甲酸与甲酸钠溶液混合,配成![]() 的
的![]() 缓冲溶液。用离子方程式表示将少量强碱加入
缓冲溶液。用离子方程式表示将少量强碱加入![]() 缓冲溶液中,
缓冲溶液中,![]() 变化不大的原因是________。
变化不大的原因是________。
②若用![]() 溶液配制
溶液配制![]() 为4的缓冲溶液,需加入________
为4的缓冲溶液,需加入________![]() (答案保留一位小数)
(答案保留一位小数)![]() 溶液。
溶液。
查看答案和解析>>
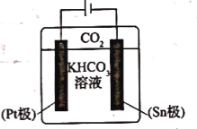
科目: 来源: 题型:
【题目】氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以![]() 、
、![]() 、
、![]() 、
、![]() 的形式存在。
的形式存在。
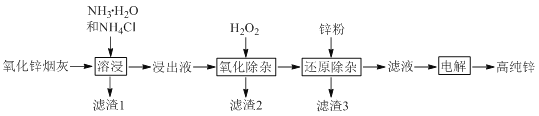
回答下列问题:
![]() 中Zn的化合价为_______,“溶浸”中ZnO发生反应的离子方程式为_______。
中Zn的化合价为_______,“溶浸”中ZnO发生反应的离子方程式为_______。
![]() 锌浸出率与温度的关系如图所示,分析
锌浸出率与温度的关系如图所示,分析![]() 时锌浸出率最高的原因为_______。
时锌浸出率最高的原因为_______。

![]() “氧化除杂”中,
“氧化除杂”中,![]() 转化为
转化为![]() 胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式为_______。
胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式为_______。
![]() “滤渣3”的主要成分为_______。
“滤渣3”的主要成分为_______。
![]() “电解”时
“电解”时![]() 在阴极放电的电极反应式为______。阳极区放出一种无色无味的气体,将其通入滴有KSCN的
在阴极放电的电极反应式为______。阳极区放出一种无色无味的气体,将其通入滴有KSCN的![]() 溶液中,无明显现象,该气体是_______
溶液中,无明显现象,该气体是_______![]() 写化学式
写化学式![]() 。电解后的电解液经补充_______
。电解后的电解液经补充_______![]() 写一种物质的化学式
写一种物质的化学式![]() 后可返回“溶浸”工序继续使用。
后可返回“溶浸”工序继续使用。
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是![]()
![]()
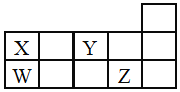
A.四种元素中原子半径最大为W,Y元素通常没有最高正价
B.酸性:![]()
C.![]() 、
、![]() 中所含化学键类型相同,熔点都很高
中所含化学键类型相同,熔点都很高
D.W、X形成的单质都是重要的半导体材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com