
科目: 来源: 题型:
【题目】为研究废旧电池的再利用,实验室利用旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的部分实验过程如图所示。下列叙述错误的是( )
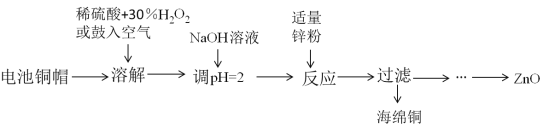
A.“溶解”操作中溶液温度不宜过高
B.铜帽溶解后,将溶液加热至沸腾以除去溶液中过量的氧气或H2O2
C.与锌粉反应的离子可能为Cu2+、H+
D.“过滤”后,将滤液蒸发结晶、过滤、洗涤、干燥后高温灼烧可得纯净的ZnO
查看答案和解析>>
科目: 来源: 题型:
【题目】下列装置或实验操作正确的是

A. ①用pH试纸测某溶液的酸碱性 B. ②探究氧化性:KMnO4>Cl2>I2
C. ③吸收氨气制氨水 D. ④中和滴定实验
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①标准状况下,1体积水中最多能溶解500体积的HCl;②饱和NaCl溶液的浓度约为5.00mol/L 。将448L(标准状况下)HCl气体溶于1L水中,所得溶液A的密度为1.20g·cm-3,则溶液A中HCl的物质的量浓度为__________。(本题计算结果均取三位有效数字)
(1)若使1L饱和NaCl溶液中的Cl-浓度与溶液A中的Cl-浓度相等,则在1L饱和NaCl溶液中还应溶解__________L标准状况下的HCl气体(溶液体积变化忽略不计)。
(2)若将10.0mL溶液A稀释成500mL溶液B,则溶液B中HCl的物质的量浓度为__________。
(3)在溶液B的配制过程中,使用前必须检查是否漏液的仪器是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铬及其化合物在生产生活中具有十分广泛的用途。工业上以铬铁矿(主要成分是Fe(CrO2)2,Cr元素为+3价。含少量MgCO3、Al2O3、SiO2等杂质)为原料制取铬酸钠(Na2CrO4)晶体,其工艺流程如图:
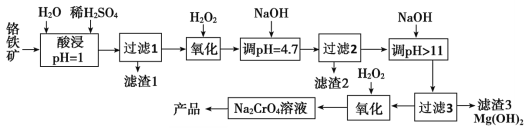
已知:+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO![]() 形式存在且易被氧化。
形式存在且易被氧化。
(1)如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成__。
(2)若省略“过滤2”步骤,产品中可能混有__(写化学式)。
(3)流程中两次使用了H2O2进行氧化,第二次氧化时反应的离子方程式为__。
(4)制取铬酸钠后的酸性废水中含有Cr2O![]() ,必须经过处理与净化才能排放。在废水中加入焦炭和铁屑,与酸性Cr2O
,必须经过处理与净化才能排放。在废水中加入焦炭和铁屑,与酸性Cr2O![]() 溶液形成原电池,使Cr2O
溶液形成原电池,使Cr2O![]() 转化为Cr3+,再用石灰乳对Cr3+进行沉降。该电池的正极反应式为__;沉降Cr3+的离子方程式为__,该反应的K=__(列出计算式)。(已知Ksp[Ca(OH2)]=8×10-6,Ksp[Cr(OH)3]=6.3×10-31)
转化为Cr3+,再用石灰乳对Cr3+进行沉降。该电池的正极反应式为__;沉降Cr3+的离子方程式为__,该反应的K=__(列出计算式)。(已知Ksp[Ca(OH2)]=8×10-6,Ksp[Cr(OH)3]=6.3×10-31)
(5)产品铬酸钠可用如图所示方法冶炼铬。
![]()
②的化学方程式为__,在实验室中引发该反应用到的两种药品是__(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 氢氧燃料电池放电时化学能全部转化为电能
B. 反应4Fe(s)+3O2(g)![]() 2Fe2O3(s)常温下可自发进行,该反应为吸热反应
2Fe2O3(s)常温下可自发进行,该反应为吸热反应
C. 3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023
D. 在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物G是一种药物合成中间体,其合成路线如图:
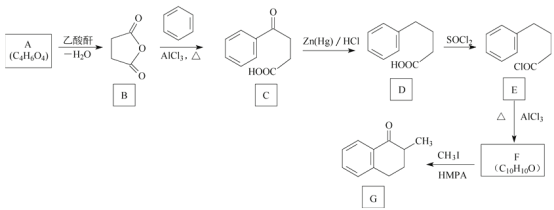
已知A分子中只含有一种官能团且能与![]() 反应生成
反应生成![]() 。回答下列问题:
。回答下列问题:
(1)A的化学名称是___________。
(2)C中的官能团名称是___________。
(3)D生成E的反应类型是___________。
(4)F的结构简式是___________。
(5)A与乙二醇在催化剂作用下反应生成可生物降解型聚酯PES,该反应的化学方程式为_________。
(6)X是G的同分异构体,满足下列条件的X共有___________种(不考虑立体异构)
①含苯环且苯环上只有三个取代基;
②含醛基且与苯环直接相连;
③除苯环外不含其他环状结构。
若①改成含苯环且苯环上只有二个取代基,其他条件不变,其中核磁共振氢谱有5组峰,面积比为6∶2∶2∶1∶1的是________(写结构简式)。
(7)由苯和甲苯制备![]() 的合成路线如下:
的合成路线如下:
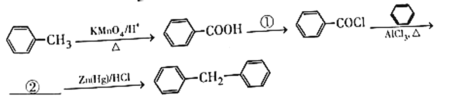
填写:①___________②___________
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.呋喃甲酸是一种抗生素,在食品工业中作防腐剂,也作涂料添加剂医药、香料等中间体,可用呋喃甲醛制备,其实验原理和制备步骤如下:
2![]() +NaOH→
+NaOH→![]() +
+![]() H<0
H<0
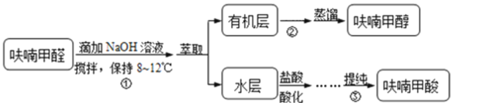
步骤③提纯过程:溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥。
(1)步骤①的关键是控制温度,其措施有:磁力搅拌、__________和缓慢滴加![]() 溶液。
溶液。
(2)步骤②中,加入无水![]() 的作用_______。
的作用_______。
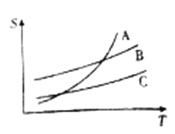
(3)呋喃甲酸在A、B、C三种溶剂中溶解度(S)随温度(T)变化的曲线如图。步骤③提纯时合适的溶解试剂是________。
Ⅱ.利用呋喃甲酸制取的呋喃甲酸正丁酯是一种优良的有机溶剂。某化学兴趣小组在实验室用呋喃甲酸和正丁醇制备呋喃甲酸正丁酯,有关物质的相关数据及实验装置如图所示:
化合物 | 相对分子质量 | 密度( | 沸点(℃) | 溶解度(g/100g水) |
呋喃甲酸 | 112 | 1.322 | 230-232 | 4.33 |
正丁醇 | 74 | 0.81 | 117.3 | 9 |
呋喃甲酸正丁酯 | 168 | 1.053 | 136.1 | 0.7 |
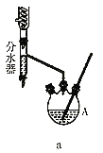

分水器的操作方法:先将分水器装满水(水位与支管口相平),再打开活塞,准确放出一定体积的水。在制备过程中,随着加热回流,蒸发后冷凝下来的有机液体和水在分水器中滞留分层,水并到下层(反应前加入的)水中;有机层从上面溢出,流回反应容器。当水层增至支管口时,停止反应。
呋喃甲酸正丁酯合成和提纯步骤为:
第一步:取足量的正丁醇和![]() 呋喃甲酸混合加热发生酯化反应,反应装置如图a所示(加热仪器已省略);
呋喃甲酸混合加热发生酯化反应,反应装置如图a所示(加热仪器已省略);
第二步:依次用水、饱和![]() 溶液、水对烧瓶中的产品洗涤并干燥;
溶液、水对烧瓶中的产品洗涤并干燥;
第三步:用装置b蒸馏提纯。
回答有关问题:
(4)装置A的名称_________。
(5)实验中使用分水器的优点有________。
(6)第二步用饱和![]() 溶液洗涤的目的是______。
溶液洗涤的目的是______。
(7)若实验中得到呋喃甲酸正丁酯![]() ,则呋喃甲酸正丁酯的产率为________。实验中呋喃甲酸正丁酯的实际产率总是小于此计算值,不可能原因是_______(填字母代号)。
,则呋喃甲酸正丁酯的产率为________。实验中呋喃甲酸正丁酯的实际产率总是小于此计算值,不可能原因是_______(填字母代号)。
A.分水器收集的水里含呋喃甲酸正丁酯
B.该实验条件下发生副反应
C.产品精制时收集部分低沸点物质
D.产品在洗涤、蒸发过程中有损失
查看答案和解析>>
科目: 来源: 题型:
【题目】参考下列图表和有关要求回答问题:
(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是___(填“增大”“减小”或“不变”,下同),ΔH的变化是__。请写出NO2和CO反应的热化学方程式:__。

(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:___。
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/kJ·mol-1 | a | b | c | x |
已知1mol白磷(P4)完全燃烧放热为dkJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=___kJ·mol-1(用含有a、b、c、d的代数式表示)。

查看答案和解析>>
科目: 来源: 题型:
【题目】电能是一种无污染、可再生的二级能源。储电材料种类繁多。如图是两种储电材料,请阅读试题,观察图片,回答问题。
Ⅰ.新型碳氮材料的储电能力应用前景广阔。其基本构成单元如图所示。
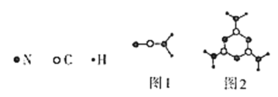
(1)图1中化学键σ键与π键之比为________;图2中碳原子的杂化方式为________。
(2)在基态![]() 原子中,核外存在_____对自旋相反的电子,核外电子占据的最高能级的电子云轮廓图为____形。
原子中,核外存在_____对自旋相反的电子,核外电子占据的最高能级的电子云轮廓图为____形。
(3)碳的最高价含氧酸根的空间构型是__________;硝酸的酸性强于亚硝酸的原因是__________。
Ⅱ.传统锂电池的主要成分是![]() ,其晶胞结构如图所示;因结构中存在笼状空隙,可以与
,其晶胞结构如图所示;因结构中存在笼状空隙,可以与![]() 和
和![]() 发生位置替换,形成储电性能更加优良的化合物
发生位置替换,形成储电性能更加优良的化合物![]() 。
。
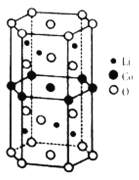
(4)基态![]() 原子的价电子排布式为_____________;化合物
原子的价电子排布式为_____________;化合物![]() 中O元素在晶胞中的位置,除了位于正六棱柱的顶点外,其他具体位置是__________。
中O元素在晶胞中的位置,除了位于正六棱柱的顶点外,其他具体位置是__________。
(5)已知化合物中各原子半径依次为:![]() ,晶胞的棱长为m,底边边长为n,该晶体的空间利用率的计算表达式为__________(用含有a、b、c、d、e、m、n的式子表示)。
,晶胞的棱长为m,底边边长为n,该晶体的空间利用率的计算表达式为__________(用含有a、b、c、d、e、m、n的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在下面的横线上填上适当的内容。
(1)![]() 个Na+约含__________mol Na+,其质量为______________g。
个Na+约含__________mol Na+,其质量为______________g。
(2)4.5molCH4约含有___________个CH4,其质量为____________g。
(3)![]() 个SO42-约含________mol SO42-,其质量为___________g;49g H2SO4 约含有______个H,共含有___________个原子。
个SO42-约含________mol SO42-,其质量为___________g;49g H2SO4 约含有______个H,共含有___________个原子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com