
科目: 来源: 题型:
【题目】羟基乙酸钠易溶于热水,微溶于冷水,不溶于醇、醚等有机溶剂。制备少量羟基乙酸钠的反应为
![]()
实验步骤如下:
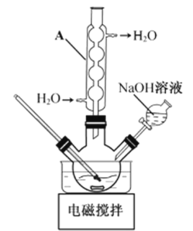
步骤1:如图所示装置的反应瓶中,加入40g氯乙酸、50mL水,搅拌。逐步加入40%NaOH溶液,在95℃继续搅拌反应2小时,反应过程中控制pH约为9。
步骤2:蒸出部分水至液面有薄膜,加少量热水,趁热过滤。滤液冷却至15℃,过滤得粗产品。
步骤3:粗产品溶解于适量热水中,加活性炭脱色,分离掉活性炭。
步骤4:将去除活性炭后的溶液加到适量乙醇中,冷却至15℃以下,结晶、过滤、干燥,得羟基乙酸钠。
(1)步骤1中,如图所示的装置中仪器A的名称是___________;逐步加入NaOH溶液的目的是____________。
(2)步骤2中,蒸馏烧瓶中加入沸石或碎瓷片的目的是_______________。
(3)步骤3中,粗产品溶解于过量水会导致产率__________(填“增大”或“减小”);去除活性炭的操作名称是_______________。
(4)步骤4中,将去除活性炭后的溶液加到适量乙醇中的目的是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验室制取气体的反应中,其原理不属于氧化还原反应的是( )
A.实验室中用稀硫酸与锌粒反应制取 H2
B.实验室中用高锰酸钾加热分解制取 O2
C.实验室中用浓盐酸与二氧化锰加热制取Cl2
D.实验室中用稀盐酸与石灰石反应制取CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸在化学工业中有着极其广泛的应用。
(1)将1.25mol的NO、NO2、N2O4混合物(其中NO的体积分数为0.60)通入水中,在空气充足的条件下完全反应后可获得硝酸的物质的量范围是_______________。
(2)向稀硝酸中加入18.4mol/L的浓硫酸(98%)作吸水剂并蒸馏得浓硝酸,当其浓度下降到87%(密度1.8g/cm3)以下时,则失去吸水能力。50mL 18.4mol/L的浓硫酸作为吸水剂时,最多可吸水_________ g。
(3)在65%的HNO3(质量m1)中加入72%的Mg(NO3)2(质量m2)后蒸馏,分别得到97.5%的HNO3和60%的Mg(NO3)2溶液(其中不含硝酸)。若蒸馏过程中,硝酸、硝酸镁均无损耗,H2O的损耗占总质量的5%,则蒸馏前投料比![]() =______________。
=______________。
(4)硝酸工业中的尾气用烧碱进行吸收产物为NaNO2、NaNO3和H2O。现有含0.50mol氮氧化物的尾气,恰好被一定量的NaOH溶液完全吸收。已知反应后溶液含有0.35mol NaNO2。若将尾气NO和NO2的平均组成用NOx表示,则x =___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动。
【探究一】
(1)甲同学将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是____________________。
【探究二】
(2)另称取铁钉6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。乙同学取336 mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O===2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为________。
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略):
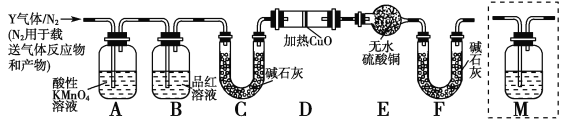
(3)装置B中试剂的作用是________。
(4)认为气体Y中还含有Q的理由是_____________________(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于________(选填序号)。
a.A之前 b.A—B间 c.B—C间 d.C—D间
(6)如果气体Y中含有H2,预计实验现象应是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵((NH4)3Fe(C6H5O7)2)。
(1)Fe基态核外电子排布式为___________;![]() 中与Fe2+配位的原子是________(填元素符号)。
中与Fe2+配位的原子是________(填元素符号)。
(2)NH3分子中氮原子的轨道杂化类型是____________;C、N、O元素的第一电离能由大到小的顺序为_______________。
(3)与NH![]() 互为等电子体的一种分子为_______________(填化学式)。
互为等电子体的一种分子为_______________(填化学式)。
(4)柠檬酸的结构简式见图。1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为_________mol。
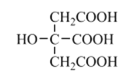
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2/ HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。
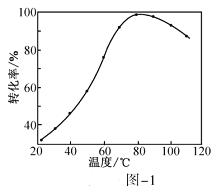
(1)CO2催化加氢。在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO-,其离子方程式为__________;其他条件不变,HCO3-转化为HCOO-的转化率随温度的变化如图-1所示。反应温度在40℃~80℃范围内,HCO3-催化加氢的转化率迅速上升,其主要原因是_____________。
(2) HCOOH燃料电池。研究 HCOOH燃料电池性能的装置如图-2所示,两电极区间用允许K+、H+通过的半透膜隔开。
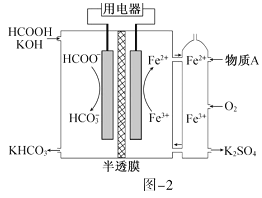
①电池负极电极反应式为_____________;放电过程中需补充的物质A为_________(填化学式)。
②图-2所示的 HCOOH燃料电池放电的本质是通过 HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为_______________。
(3) HCOOH催化释氢。在催化剂作用下, HCOOH分解生成CO2和H2可能的反应机理如图-3所示。
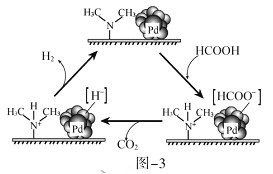
①HCOOD催化释氢反应除生成CO2外,还生成__________(填化学式)。
②研究发现:其他条件不变时,以 HCOOK溶液代替 HCOOH催化释氢的效果更佳,其具体优点是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为氮及其化合物的类别与化合价对应的关系图。
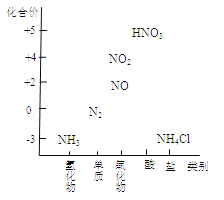
(1)实验室制取氨气。
① 化学方程式是_______。
② 可用向下排空气法收集氨气的原因是_______。
③ 用水吸收多余的氨气时,如将导管直接插入水中,
会产生倒吸现象,产生该现象的原因是_______。
(2)完成下列能生成NO的化学方程式:
① 体现N元素的还原性:
a. 汽车尾气中产生的NO:N2 + O2 ![]() 2NO。
2NO。
b. 氨的催化氧化:_________。
② 体现N元素的氧化性:_________。
(3)NO2 易溶于水。将体积为V mL的试管充满NO2后倒扣在水中,见下图。
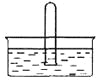
① NO2溶于水的化学方程式是_________。
② 使试管中NO2完全被水吸收的操作是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】3.04 g铜镁合金完全溶解于100 mL 14.0 mol/L的浓硝酸中,得到NO2和N2O4的混合气体2240 mL(标准状况),向反应后的溶液中加入2.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到5.08 g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2∶1
B.被还原的硝酸的物质的量是0.12 mol
C.得到5.08 g沉淀时,加入NaOH溶液的体积是700 mL
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物F是合成某种抗肿瘤药物的重要中间体,其合成路线如下:

(1)A中的含氧官能团名称为硝基、__________和____________。
(2)B的结构简式为______________。
(3)C→D的反应类型为___________。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式________。
①能与FeCl3溶液发生显色反应。
②能发生水解反应,水解产物之一是α-氨基酸,另一产物分子中不同化学环境的氢原子数目比为1:1且含苯环。
(5)写出以CH3CH2CHO和![]() 为原料制备
为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)________。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)________。
查看答案和解析>>
科目: 来源: 题型:
【题目】屠呦呦率领团队先后经历了用水、乙醇、乙醚提取青蒿素的过程,最终确认只有采用低温、乙醚冷浸等方法才能成功提取青蒿素。研究发现青蒿素中的某个基团对热不稳定,该基团还能与NaI作用生成I2 。碳原子连有4个不同的原子或基团时,该碳称为手性碳,下列分析不正确的是
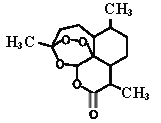
A. 推测青蒿素在乙醚中的溶解度大于在水中的溶解度
B. 青蒿素可以与NaOH、Na2CO3 、NaHCO3反应
C. 青蒿素分子中含有手性碳
D. 青蒿素中对热不稳定且具有氧化性的基团是“-O-O-”
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com