
科目: 来源: 题型:
【题目】实验室研究某些气体的性质可用如图所示装置,下列过程和结论均正确的是

项选 | X | Y | Z | 结论 |
A | Br2 | 苯 | NaOH 溶液 | 苯与溴发生取代反应 |
B | SO2 | 酸性KMnO4溶液 | NaOH 溶液 | 二氧化硫具有漂白性 |
C | HCl | Na2SiO3溶液 | NaCl 溶液 | Cl 的非金属性强于Si |
D | CH2= CH2 | Br2 的CCl4溶液 | AgNO3溶液 | 乙烯与Br2发生加成反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.常温下,0.1mol·L-1某一元酸(HA)溶液中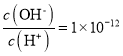 ,加入少量NaA晶体或加水稀释,溶液中c(OH-)均增大
,加入少量NaA晶体或加水稀释,溶液中c(OH-)均增大
B.已知:0.1mol·L-1KHC2O4溶液呈酸性,则存在关系:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)>c(H+)>c(OH-)
C.25℃,H2SO3![]() HSO3—+H+的电离常数Ka=1×10-2mol·L-1,该温度下NaHSO3水解反应的平衡常数Kh=1×10-12mol·L-1
HSO3—+H+的电离常数Ka=1×10-2mol·L-1,该温度下NaHSO3水解反应的平衡常数Kh=1×10-12mol·L-1
D.0.1mol·L-1NaHSO4溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】磁性材料产业是21 世纪各国竞相发展的高科技支柱产业之一,碳酸锰(MnCO3)可制造电信器材的软磁铁氧体。工业上利用软锰矿(主要成分为 MnO2,含少量SiO2、Fe2O3、CuO 等杂质)和含SO2的烟气为主要原料制备无水碳酸锰的工艺流程如下:

已知:①MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃ 时开始分解。
②不同金属离子生成氢氧化物沉淀的 pH 和有关物质的 Ksp 如下表:
离子 | Fe3+ | Fe2+ | Cu2+ | Mg2+ | ||||
开始沉淀的pH | 2.7 | 7.5 | 4.2 | 7.8 | ||||
沉淀完全的pH | 3.7 | 9.7 | 6.7 | 9.8 | ||||
物质 | MnS | CaF2 | CuS | |||||
Ksp | 2.5×10-13 | 1.5×10-10 | 1.3×10-36 | |||||
回答下列问题:
(1)为提高“溶浸”过程中的浸取速率,以下方法不能提高浸取速率的是________。
A.将矿石研磨粉碎 B.连续搅拌 C.延长浸取时间 D.升高温度 E.适当增大稀硫酸的浓度
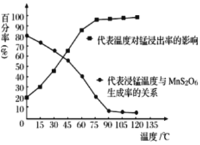
“溶浸”过程中往往有副产物MnS2O6 生成,温度对“溶浸”反应的影响如下图所示, 为减少MnS2O6的生成,“溶浸”的适宜温度应大于___。
(2)“除铁”步骤中,在加入石灰调节溶液的pH前,加入适量的软锰矿,发生反应的离子方程为____。
(3) “净化”步骤的目的是除去溶液中的Ca2+、Cu2+等杂质。若测得滤液中 c(F-)=0.02molL-1,则滤液中残留的c(Ca2+) =__。
(4) “沉锰”步骤中 ,加入 NH4HCO3后有无色无味的气体放出, 发生反应的离子方程式为______。
(5)从“沉锰”步骤中要得到纯净无水MnCO3,先将析出的 MnCO3沉淀过滤,再用_______(填化学式)洗涤更易于干燥。过滤后废液的主要成分为____(填化学式)。
(6)实际生产中, 运用阴离子交换膜法电解得到金属锰,电解装置如下图所示,B电极为直流电源的_________极。该工艺若不使用离子交换膜, 会造成Mn2+发生副反应生成 MnO2, 写出该副反应的电极反应式_______。

查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏伽德罗常数的数值,下列说法不正确的是
A.500mL 0.1mol/L的Na2SO4溶液中含Na+数目为0.1NA
B.标准状况下,11.2L H2O含有氧原子大于0.5NA
C.常温常压下,32 g氧气(O2)和臭氧(O3)的混合气体中含有的氧原子数为2NA
D.标准状况下,2.24 L N2和O2的混合气体中原子数为0.1NA
查看答案和解析>>
科目: 来源: 题型:
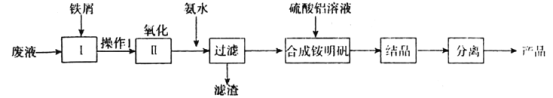
【题目】某研究小组利用某酸性腐蚀废液(含Fe3+、Cu2+、NH4-、SO42-),制取铵明矾[NH4Al(SO4)2·12H2O]的流程如下:
回答下列问题:
(1)加入铁屑的目的是______________________。
(2)第II步中用双氧水作为氧化剂。请写出步骤II氧化反应离子方程式__________________。
(3)检验溶液中含有NH4+的方法是______________________。
(4)工业上将流程中产生的滤渣用NaClO碱性溶液氧化可生成一种高效净水剂(Na2FeO4),写出对应的离子方程式:_________________________________。
(5)固体铵明矾加热过程中,固体质量随温度的变化如图所示。
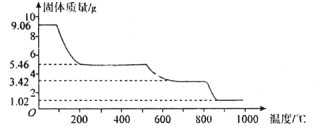
若将铵明矾加热灼烧,400℃时剩余固体成分的化学式为___________。在温度从800℃到950℃的过程中得到的两种氧化物,一种为固体,一种为氧化性气体,该气体的名称是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A为常见的金属单质,根据如图所示的关系:
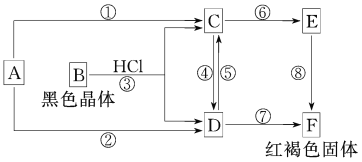
(1)确定A、B、C、D、E、F的化学式:A____________,B____________,C____________,D____________,E____________,F____________。
(2)写出⑧的化学方程式________,④、⑤的离子方程式________,_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下转化关系,E为淡黄色粉末,通常用在呼吸面具中作为氧气的来源。

(1)A、C、E、F的化学式:
A______,C______,E______,F______。
(2)向饱和的C的溶液中通入足量CO2,会出现的现象是_____,有关反应的化学方程式为____。
(3)鉴别C与F溶液应选用的试剂是_____,有关反应的离子方程式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】苯二氮卓类药物氟马西尼(F)的合成路线如下图所示。请回答下列问题:
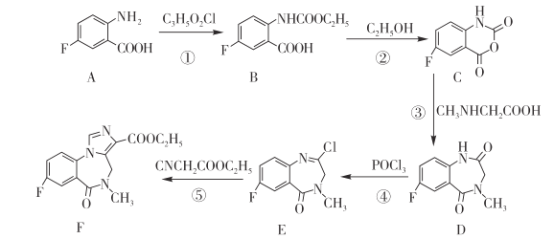
(1)A中官能团有氟原子、_____和________。(均填名称)
(2)C3H5O2Cl的结构式为________。
(3)反应①和②的反应类型相同,其反应类型是___________。
(4)化合物 D的分子式为___________。
(5)反应⑤生成“ 物质 F” 和 HCl,则 E→F的化学反应方程式为________。
(6)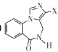 是 F的同分异构体,其中 X部分含—COOH且没有支链,满足该条件的同分异构体有______种(不考虑立体异构)。
是 F的同分异构体,其中 X部分含—COOH且没有支链,满足该条件的同分异构体有______种(不考虑立体异构)。
(7)已知氨基酸之间脱水能够形成含肽键的化合物,请设计由甘氨酸(HOOCCH2NH2)和CNCH2COOC2H5制备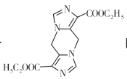 的合成路线________(无机试剂任选)。
的合成路线________(无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧乙酸(CH3COOOH)不仅在卫生医疗、食品消毒及漂白剂领域有广泛应用,也应用于环境工程、精细化工等领域。实验室利用醋酸(CH3COOH)与双氧水(H2O2)共热, 在固体酸的催化下制备过氧乙酸(CH3COOOH),其装置如下图所示。请回答下列问题:
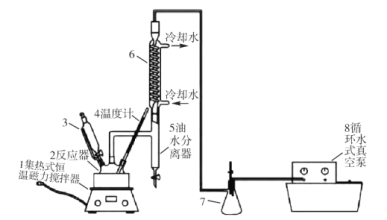
实验步骤:
I.先在反应瓶中加入冰醋酸、乙酸丁酯和固体酸催化剂,开通仪器1和8,温度维持为55℃;
II.待真空度达到反应要求时,打开仪器3的活塞,逐滴滴入浓度为35%的双氧水,再通入冷却水;
Ⅲ.从仪器 5定期放出乙酸丁酯和水的混合物,待反应结束后分离反应器2中的混合物,得到粗产品。
(1)仪器 6的名称是______,反应器 2中制备过氧乙酸(CH3COOOH)的化学反应方程式为_____。
(2)反应中维持冰醋酸过量,目的是提高_____;分离反应器 2中的混合物得到粗产品,分离的方法是_________。
(3)实验中加入乙酸丁酯的主要作用是_________(选填字母序号)。
A 作为反应溶剂,提高反应速率
B 与固体酸一同作为催化剂使用,提高反应速率
C 与水形成沸点更低的混合物,利于水的蒸发,提高产率
D 增大油水分离器 5的液体量,便于实验观察
(4)从仪器 5定期放出乙酸丁酯和水的混合物,待观察到___________(填现象)时,反应结束。
(5)粗产品中过氧乙酸(CH3COOOH)含量的测定:取一定体积的样品 VmL,分成 6等份,用过量 KI溶液与过氧化物作用,以 0.1mol L-1的硫代硫酸钠溶液滴定碘(I2+2S2O32-=2I-+S4O62-);重复 3次,平均消耗量为 V1mL。再以 0.02mol L-1的酸 性高锰酸钾溶液滴定样品,重复 3次,平均消耗量为 V2mL。则样品中的过氧乙酸的浓度为 ______mol L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com