
科目: 来源: 题型:
【题目】以冶铜工厂预处理过的污泥渣(主要成分为 CuO 和 Cu)为原料制备 CuSO45H2O 晶体的流程如下 :
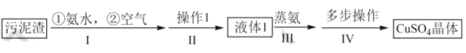
已知:①CuO在氨水作用下可以生成 Cu(NH3)4(OH)2
②CuSO45 H2O 加热到 4 5℃时开始失水。
请回答:
(1)步骤 l 中,空气的主要作用是____。
(2)下列关于步骤II说法不正确的是____。
A.操作 1 可选择倾析法过滤, 玻璃棒的作用是: 先搅拌, 再引流
B.操作 1 应趁热过滤, 要防止液体 1 中的溶质因冷却而析出
C.操作 1 为抽滤,在加入需抽滤的物质时,用玻璃棒引流液体, 玻璃棒底端需紧贴在滤纸上
D.抽滤时,布氏漏斗的底部斜口面需正对抽滤瓶的抽气口处, 是为了提高抽滤的速率
(3)液体 1 通过步骤 III 与步骤IV可得到CuSO45 H2O 晶体 。
①蒸氨过程的生成物均是由两种元素组成的化合物, 则除氨外其余产物的化学式为_____。
②步骤IV中包含多步操作, 将下列步骤按正确的步骤排序(必要时步骤可重复选)。_____→得到固体物质→ ____ →将液体放于蒸发皿中加热→ ____→_____→_____→_____ →得到晶体
a.过滤 b.用玻璃棒不断搅拌溶液 c.用足量稀硫酸溶解固体 d.停止加热 e.至溶液表面析出晶膜
(4)步骤1中分别选用氨水、氨水-碳酸铵混合溶液氨浸时, 铜元素回收率随温度变化如图所示。
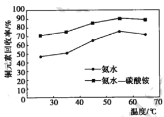
①浸取液为氨水时,反应温度控制为 55℃,温度过高铜元素回收率降低的原因是_______。
②浸取液为氨水一碳酸铵混合溶液时,铜元素回收率受温度影响较小的原因可能是______。
(5)为了提高 CuSO4晶体的产率, 实验室还采用以下方法: 将CuSO4 溶液转移至蒸馏烧瓶中, 加入适量冰醋酸, 通过下图所示的装置获取晶体。
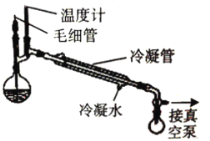
①加入适量乙酸的目的是:_____。
②图中接真空泵的作用是:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
A. 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为(7/22.4)NA
B. 1 mol甲基(-CH3)所含的电子总数为9NA
C. 0.5 mol1,3-丁二烯分子中含有碳碳双键数为NA
D. 1 mol碳正离子(CH3+)所含的电子总数为8NA
查看答案和解析>>
科目: 来源: 题型:
【题目】根据已经学过的化学知识,回答下列问题。
I.金属及其化合物在生产生活中有着广泛的应用,
(1)胃舒平(主要成分为氢氧化铝)可用于治疗胃酸过多,氢氧化铝体现_______性;_______(填“能”或“不能”)用氢氧化钠溶液代替。
(2)将Cu与稀硫酸混合,二者不能反应,滴入H2O2后,溶液很快变成蓝色,该反应的化学方程式为____________________________________________。
(3)NaHSO4是一种酸式盐,写出NaHSO4在水中的电离方程式_________________________。
II.物质的量是学习化学的基础。
(1)14.4 g CO和CO2的混合气体在标准状况下所占的体积为8.96 L,其中CO的质量为_____。
(2)市售浓H2SO4的质量分数为98%、密度为1.84g/cm3,其浓度为________mol·L-1。
(3)19g某二价金属的氯化物ACl2中含有0.4mo1Cl-离子,金属A的相对原子质量是_______。
(4)根据反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,可知当有2.5 mol FeS2参加反应时,被氧化的硫的物质的量为_______mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)COCl2的空间构型为______________,溴的基态原子价电子排布式为_____________。
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____________(填字母)式发生。
A.CsICl2====CsCl+ICl B.CsICl2====CsI+Cl2
(3)根据表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是____。
元素 | 氟 | 氯 | 溴 | 碘 |
第一电离能/ (kJ·mol-1) | 1681 | 1251 | 1140 | 1008 |
(4)下列分子既不存在“s-p”σ键,也不存在“p-p”π键的是__________(填字母)。
A.HCl B.HF C.SO2 D.SCl2
(5)已知ClO2-为“V”形,中心氯原子周围有4对价层电子。ClO2-中心氯原子的杂化轨道类型为______________,写出一个与CN—互为等电子体的物质的分子式:______________。
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示,由此可判断钙的氧化物的化学式为__________。已知该氧化物的密度是ρg·cm-3,则晶胞内离得最近的两个钙离子的间距为_________cm(只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA)。

查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问题:
(1)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
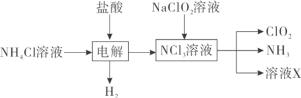
①电解时阳极电极反应式为__________________________。
②除去ClO2中的NH3可选用的试剂是___________(填标号)。
a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水
(2)用如图装置可以测定混合气中ClO2的含量:
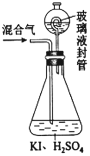
Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸:
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用0.1000mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为______________________。
②玻璃液封装置的作用是______________________。
③V中加入指示剂,滴定至终点的现象是______________________。
④测得混合气中ClO2的质量为______g。
⑤某同学用某部分刻度模糊不清的50mL滴定管进行实验,当滴定管中的液面处于如图所示的刻度处,则管内液体的体积________(填代号)。
a.等于23.60mL b.等于27.60mL c.小于23.60mL d.大于27.60mL
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是用KClO3与浓盐酸反应制取氯气的简易装置。下列说法正确的是
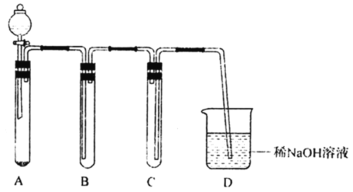
A.A中固体也可以用高锰酸钾、重铬酸钾、二氧化锰等代替
B.装置A发生反应的方程式为KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O
C.待没有气泡产生后,向A中加入足量AgNO3,根据沉淀质量可求出剩余盐酸的量
D.装置B盛放的是饱和食盐水,目的为除去HCl
查看答案和解析>>
科目: 来源: 题型:
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在2020年抗击新型冠状病毒肺炎中被广泛用于消毒,其有效成分是NaClO。某校化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。
已知:①室温下,饱和NaClO溶液pH为11
②25℃时,H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11;HClO:Ka=3.0×10-8
I.制备NaClO溶液
该学习小组按下图装置进行实验(部分夹持装置省去)
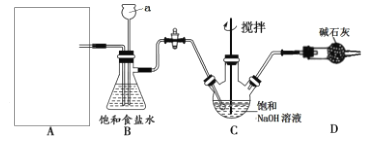
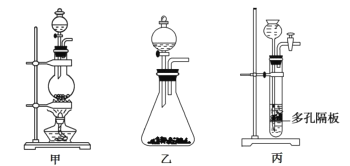
(1)上图中A为实验室制备Cl2的发生装置,可以选用下列图中_(填代号)装置,用该装置制备Cl2反应的化学方程式为__。
(2)B装置中仪器a的名称是____,B装置可除去氯气中氯化氢杂质, 此外还有______作用(写出一点)。
II.NaClO性质探究
按上图装置进行实验,一段时间后,取C瓶中的溶液进行实验,如下表:
实验内容 | 实验现象 | |
实验l | 取样,滴加紫色石蕊试液 | 变蓝,不褪色 |
实验2 | 测定溶液的pH | 12 |
(3)C瓶溶液中的溶质除NaCl外,还有______(填化学式)。
(4)将C瓶中NaOH溶液换成NaHCO3溶液,反应一段时间后,取C瓶中的溶液按上表实验内容进行实验。现象为:实验l中紫色石蕊试液立即褪色,实验2中溶液的pH=7。结合平衡移动原理解释紫色石蕊试液立即褪色的原因是________。
III.测定C瓶溶液中NaClO含量(单位:g·L-1)
i.取C瓶溶液10.00mL于锥形瓶中,加入适量硫酸酸化,迅速加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
ii.用0.1000molL-1Na2S2O3标准溶液滴定上述锥形瓶中的溶液至终点,重复操作2~3次,消耗Na2S2O3溶液的平均用量为12.00mL。(已知:I2+2![]() =2I-+
=2I-+![]() )
)
(5)i中主要发生反应的离子方程式为_______,ii中用_______作指示剂。
(6)盖紧瓶塞并在暗处反应的原因是________。
(7)C瓶溶液中NaClO含量是______g·L-1(保留2位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图象表示的意义与相关的化学反应完全正确的是
A.向FeCl3溶液中不断加入铁粉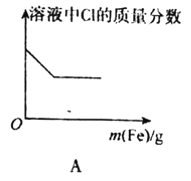
B.Fe(OH)2固体露置在空气中质量的变化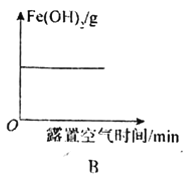
C.25℃时,向Cl2水溶液中通入二氧化硫(生成两种常见的酸) 
D.向AlCl3溶液中不断滴入烧碱溶液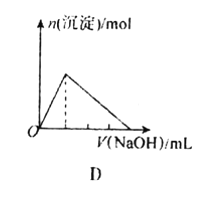
查看答案和解析>>
科目: 来源: 题型:
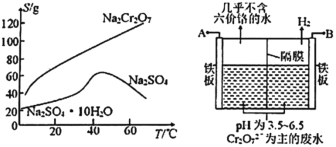
【题目】铬渣是生产金属铬和铬盐过程中产生的工业废渣,其中含有Na2SO4及少量Cr2O72—、Fe3+。从铬渣中提取Na2SO4的工艺流程:
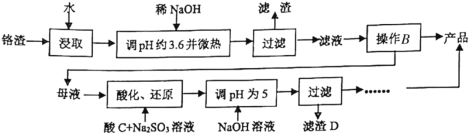
已知:常温时,Fe3+、Cr3+完全沉淀时c≤1×10-5mol·L-1,Ksp[Fe(OH)3]=4×10-38,Ksp[Cr(OH)3]=6×10-31。
(1)调pH约为3.6目的是_________。
(2)根据下图溶解度(S)—温度(T)曲线,判断操作B为蒸发浓缩、_________________。
(3)“酸化、还原”步骤反应的离子方程式为_______________________________。
(4)滤渣D为________________________(填化学式)。
(5)如图,某工厂采用电解法处理含铬废水,用铁板作阴阳极,槽中盛放含铬废水,A接电源的_______极;阳极区溶液中发生的氧化还原反应为__________________。若不考虑气体的溶解,当收集到6.72L(标准状况)的H2时,理论上有___molCr2O72—被还原。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下列实验装置能完成相应实验的是
选项 | 装置图 | 实验目的 |
A |
| 收集干燥的HCl |
B |
| 除去CO2中含有的少量HCl |
C |
| 收集H2、NH3、CO2、Cl2、HCl、NO、NO2等气体 |
D |
| 检查装置的气密性 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com