
科目: 来源: 题型:
【题目】(1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H)。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol—1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
①比较下列两组物质的熔点高低(填“>”或“<”=)
SiC_____________Si;SiCl4_____________SiO2
②工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)该反应的反应热△H=_____________kJ/mol.
Si(s)+4HCl(g)该反应的反应热△H=_____________kJ/mol.
(2)已知化合物Na2O的晶胞如图。
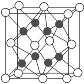
①其中O2-离子的配位数为________,
②该化合物与MgO相比,熔点较高的是________。(填化学式)
③已知该化合物的晶胞边长为apm,则该化合物的密度为___g·cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA)。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖花落锂离子电池,美英日三名科学家获奖,他们创造了一个可充电的世界。像高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜,主要作用是在反应过程中只让Li+通过。结构如图所示。
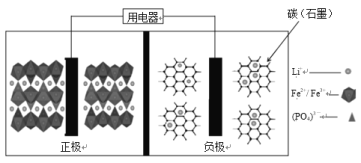
原理如下:(1 x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC,下列说法不正确的是
LiFePO4+nC,下列说法不正确的是
A.放电时,正极电极反应式:xFePO4+xLi++xe=xLiFePO4
B.放电时,电子由负极经导线、用电器、导线到正极
C.充电时,阴极电极反应式:xLi++nC=LixCn-xe
D.充电时,Li+向左移动
查看答案和解析>>
科目: 来源: 题型:
【题目】按照下列元素基态原子的电子排布特征判断元素,并回答问题:
A原子中只有一个电子层且只含有一个电子;B原子的3p轨道上得到一个电子后不能再容纳外来电子;C原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反;D原子的第三电子层上有8个电子,第四层上只有1个电子;E原子的价电子排布式为3s23p6。
(1)以下分别是哪种元素(用元素符号填空):
A:_____________;C:_____________;D:____________;
(2)B原子的核外电子排布式_____________;写出A的负一价阴离子的电子式_____________。
(3)E的原子结构示意图_____________。
(4)写出由A、C两元素形成的18e-分子的形成过程:_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】向20 mL某浓度的AlCl3溶液中滴加2 mol·L-1的NaOH溶液时,得到Al(OH)3沉淀的质量(g)与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
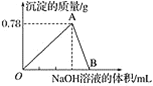
(1)图中A点表示的沉淀是__________(写化学式),其物质的量为____________。
(2)反应至A点时消耗NaOH溶液的体积为______________。
(3)图中B点溶液中的溶质有________________。
(4)AlCl3溶液的浓度为______________。
(5)O点到B点反应的总离子方程式可表示为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高锰酸钾是中学常用的试剂。工业上用软锰矿制备高锰酸钾流程。

(1)上述流程中可以循环使用的物质有________、________(写化学式)。
(2)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是________(填代号)。
a.84消毒液(NaClO溶液) b.75%酒精c.苯酚
(3)理论上(若不考虑物质循环与制备过程中的损失)1molMnO2可制得________molKMnO4。
(4)操作Ⅰ的名称是________;操作Ⅱ根据KMnO4和K2CO3两物质在________(填性质)上的差异,采用________(填操作步骤)、趁热过滤得到KMnO4粗晶体。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸锰是制造电信器材软磁铁氧体、合成二氧化锰和制造其它锰盐的原料,用于医药、电焊条辅助原料等。工业上用氯化铵焙烧菱锰矿粉制备高纯度碳酸锰的工艺流程如下:
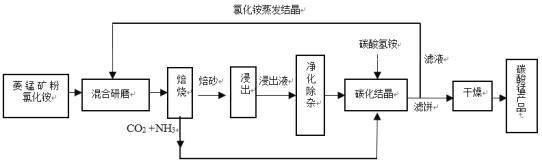
已知:①菱锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子浓度c(Mn+)=0.1 mol L -1,形成M(OH)n沉淀的pH范围如下:
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Mg2+ |
开始沉淀的pH | 6.3 | 1.5 | 3.8 | 8.8 | 9.6 |
沉淀完全的pH | 8.3 | 2.8 | 5.2 | 10.8 | 11.6 |
③常温下,Ksp(CaF2) =1.46×10-10,Ksp(MgF2) = 7.30×10-11
回答下列问题:
(1)混合研磨成细粉的目的是_________________。
(2)“焙烧”时发生的主要反应的化学方程式为_____________。
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为________;再调节溶液pH范围为________将Al3+、Fe3+变为沉淀除去;再加入NH4F沉淀Ca2+、Mg2+,当c(Ca2+)=1.0×10-5molL-1时,c(Mg2+)=______molL-1。
(4)碳化结晶过程中不能用(NH4)2CO3溶液代替NH4HCO3溶液可能的原因是_________。
(5)在操作流程中可以循环利用的物质是__________。
(6)测定碳酸锰产品的纯度。
称取0.2500g碳酸锰产品于锥形瓶中,加25.00 mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至50 mL,滴加2~3滴指示剂,然后用浓度为0.2000 mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2![]() )。重复操作3次,记录数据如下表:
)。重复操作3次,记录数据如下表:
滴定 次数 | 0.2000mol·L-1的硫酸亚铁铵标准溶液读数(mL) | |
滴定前 | 滴定后 | |
1 | 0.10 | 10.20 |
2 | 0.22 | 11.32 |
3 | 1.05 | 10.95 |
则产品的纯度=____________,若滴定终点时俯视读数,则测得的碳酸锰粗产品的纯度__________。(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
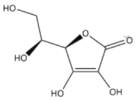
【题目】维生素C,结构简式如下图。可用碘量法测定含量。取2片维生素C片剂,溶于蒸馏水,定容至250mL,取50mL,用0.0l0mol/LI2标准液滴定至终点,重复实验,数据如下:
序号 | 滴定前读数 | 滴定后读数 |
1 | 1.00 | 25.98 |
2 | 1.24 | 25.36 |
3 | 1.38 | 26.40 |
已知:维生素C与I2按等物质的量恰好反应。
(1)该维生素C片溶液中维生素C的浓度为___mg/L。
(2)移取80mL橙汁于锥形瓶中,滴入lmL盐酸调节酸度,用0.010mol/LI2的标准溶液滴定至终点,消耗标准液10.12mL,则橙汁中维生素C的含量为____mg/L。简要写出计算过程。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知Al(OH)3是两性氢氧化物,但不溶于弱碱溶液氨水,也不溶于弱酸碳酸。试用离子方程式说明原理:_____、_____。
(2)分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子均满足8电子稳定结构。写出(CN)2的电子式_____。
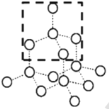
(3)请在下图的虚线框中补充完成SiO2晶体的结构模型示意图____,(部分原子已画出),并进行必要的标注。
查看答案和解析>>
科目: 来源: 题型:
【题目】①在NH4NO3中氮元素显+5价;
②4FeS2+11O2![]() 2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化;
2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化;
③2Cu+O2![]() 2CuO反应中Cu元素化合价降低总数与O元素化合价升高总数一定相等。这3种说法中错误的是
2CuO反应中Cu元素化合价降低总数与O元素化合价升高总数一定相等。这3种说法中错误的是
A.①B.②③C.①③D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com