
科目: 来源: 题型:
【题目】苯乙烯(![]() )是制造一次性泡沫饭盒的聚苯乙烯的单体,其合成所涉及到的反应如下:
)是制造一次性泡沫饭盒的聚苯乙烯的单体,其合成所涉及到的反应如下:
I.CO2(g)+H2(g)CO(g)+H2O(g)△H1
Ⅱ.![]() (g)
(g) ![]() (g)+H2(g) △H2
(g)+H2(g) △H2
Ⅲ. ![]() (g)+CO2(g)
(g)+CO2(g) ![]()
![]() (g)+CO(g)+H2O(g) △H3
(g)+CO(g)+H2O(g) △H3
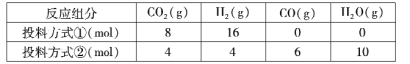
(1)T℃时,2L密闭容器中进行的反应Ⅰ,若按投料方式①进行投料,15 min后反应达到平衡,此时CO2的转化率为75%,则0~15 min内平均反应速率υ( H2)= ________;若按投料方式②进行投料,则开始反应速率υ正(H2) ______υ逆(H2)(填“>”“<”或“=”)。
(2)则△H2=____________(用含有△H1和△H3的式子表达)。
(3)研究表明,温度、压强对反应Ⅲ中乙苯平衡转化率的影响如图所示:

则△H3 ______0(填“>”“<”或“=”);P1、P2、P3从大到小的顺序是 __________ 。
(4)除了改变温度和压强,请提供另外一种可以提高苯乙烯产率的方法__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如何降低大气中CO2的含量及有效地开发利用碳资源的研究越来越紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质.
(1)工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
如表所列数据是反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断△H ________0 ( 填“>”、 “ < “ 或 “ = ”) ;
②判断反应达到平衡状态的依据是________.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的平均相对分子质量不变
C.混合气体的密度不变
D.CH3OH、CO、H2的浓度都不再发生变化
③借助上表数据判断,要提高CO的转化率,可采取的措施是________.
A.升温 B.充入更多H2 C.分离出甲醇 D.加入催化剂
(2)CH3OH可以用做燃料电池的燃料,以甲醇与氧气的反应为原理设计,现有电解质溶液是KOH溶液的燃料电池。请写出该电池负极的电极反应式:____________________.
(3)向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生反应:BaSO4(s)+CO32-(aq)BaCO3(s)+SO42-(aq)。已知某温度下该反应的平衡常数K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则 BaCO3的溶度积Ksp=________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求写出下列物质间反应的离子反应方程式:
(1)NaHSO4溶液与NaHCO3溶液混合:___。
(2)将NaHSO4与Ba(OH)2在溶液中按物质的量之比1∶1混合:___。
(3)向20mL0.3mol/L的Ca(HCO3)2溶液中加入20mL0.3mol/L的NaOH溶液,反应的离子方程式:__;继续加入10mL0.3mol/L的NaOH溶液,反应的离子方程式:__。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)26H2O,相对分子质量392]晶体又称莫尔盐,易溶易电离但却比一般的亚铁盐稳定,因此广泛应用于制药、电镀以及定量分析。回答下列与之有关的问题:
(1)在莫尔盐所涉及的五种元素中:
①S元素在门捷列夫元素周期表中的位置是 ______________ ;
②其中处于同主族的两种元素非金属性更强的是:_____________。
(2)为检验莫尔盐是否变质,可用的试剂为_______________。
碘是合成人体甲状腺激素的重要原料,食盐中加KIO3是我国为解决普遍性碘缺乏问题的国家规定,下图是自动电位滴定法测定食盐中碘含量的实验过程:
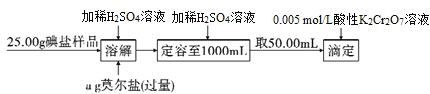
(3)已知“溶解”过程中IO3-的还原产物为碘单质,写出该反应的离子反应方程式:______________________________。
(4)取50. 00 mL样品,用0.005 mol/L酸性K2Cr2O7溶液滴定剩余Fe2+,滴定操作时使用的锥形瓶未干燥,导致结果_____________(填“偏大”“偏小”或“无影响”)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)汽车常装有安全气囊,当发生强烈碰撞时,瞬间引发以下反应:2NaN3=2Na+3N2↑,所产生的气体快速充满气囊,可以达到保护车内人员的目的。
①若130gNaN3完全分解,在标准状况下,气囊膨胀的体积约为___。
②该反应中的氧化剂是___,氧化产物是___。
(2)O3能与KI溶液反应,生成一种能使带火星木条复燃的气体,向反应后溶液中滴入酚酞变为红色,若滴入淀粉溶液则变为蓝色。为测定大气中O3的含量,将0℃、1.01×105Pa、33.6m3的空气通入KI溶液,使之完全反应,再向所得溶液中滴加0.01mol/L的Na2S2O3溶液60mL恰好与之完全反应。(I2与Na2S2O3的反应式:2NaS2O3+I2=Na2S4O6+2NaI)
①写出并配平O3与KI溶液反应的化学方程式___;
②计算大气中O3的体积分数(即O3的体积与空气体积的比值,用科学记数法表示)___。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)在该反应中,如有1molCl2生成,被氧化的HCl的物质的量是__,转移电子的数目是___。
(2)在反应3Cl2+6KOH(浓)=5KCl+KClO3+3H2O中,氧化产物与还原产物的物质的量之比为___,3molCl2参加该反应时,反应中转移___mol电子。
(3)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是___。
(4)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)___。
查看答案和解析>>
科目: 来源: 题型:
【题目】一氯化硫(S2Cl2)是一种重要的有机合成氯化剂,实验室和工业上都可以用纯净干燥的氯气与二硫化碳反应来制取(CS2+3Cl2![]() CCl4+S2Cl2),其装置如下:
CCl4+S2Cl2),其装置如下:
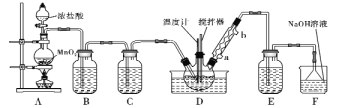
(1)A装置中的离子反应方程式为 ________________________________________________。
(2)一氯化硫(S2Cl2)常温下为液态,较为稳定,受热易分解,易被氧化,且遇水即歧化,歧化产物中不仅有淡黄色固体,而且还有两种气体,用NaOH溶液吸收该气体可得两种盐Na2SO3和NaCl。 写出一氯化硫与水反应的化学反应方程式:____________________________。
(3)C、E装置中所盛溶液为__________。
(4)D中冷凝管的冷水进水口为____(填“a”或“b”);实验过程中,需要先点燃A处酒精灯,通入氯气一段时间后方可向D中水槽里面加入热水加热,这样做的目的是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向200mL FeBr2溶液中逐渐通入C12,其中n(Fe3+)、n(Br2)随通入n(Cl2)的变化如图所示,下列说法不正确的是( )

A.氧化性强弱:Br2>Fe3+
B.由图可知,该FeBr2溶液的浓度为1molL─1
C.n(Cl2)= 0.12 mol时,溶液中的离子浓度有c(Fe3+):c(Br-)=1:8
D.c(FeBr2):c(Br2)= 1: 1时,反应的离子方程式:2Fe3++2Br-+2Cl2=2Fe3++Br2+4Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法错误的是
A.标准状况下,以任意比混合的氢气和一氧化碳气体共8.96L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2NA
B.用惰性电极电解硫酸铜溶液时,若溶液的pH值变为1时,则电极上转移的电子数目为NA
C.32.5 g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.5NA
D.反应3H2(g)+N2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1,当放出热量9.2 kJ时转移电子0.6NA
2NH3(g) ΔH=-92 kJ·mol-1,当放出热量9.2 kJ时转移电子0.6NA
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究铁与稀硝酸之间的反应,某同学设计装置如下:
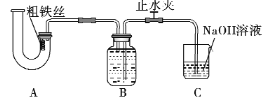
下列有关说法错误的是
A.从U型管左侧加入稀硝酸,应该打开右边的止水夹,否则硝酸无法完全浸没铁丝
B.反应结束后,在A装置中检测到了Fe2+,说明过量稀硝酸只能将铁氧化到正二价
C.B装置的作用是收集还原产物NO的,该气体不适合用排空气法收集
D.C装置吸收尾气需要O2参与反应:4NaOH +4NO +3O2 =4NaNO3 +2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com