
科目: 来源: 题型:
【题目】如图是部分短周期元素主要化合价与原子序数的关系图,下列说法不正确的是( )
A. X和W位于同一主族
B. 原子半径:Y>Z>X
C. 盐YRX与化合物WX2的漂白原理相同
D. Y和R两者的最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目: 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.100 mol·L-1的NaOH溶液滴定10.00 mL浓度均为0.100 mol·L-1 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线②代表滴定CH3COOH溶液的曲线
B. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C. 在相同温度下,A、B、C三点溶液中水的电离程度: A<C<B
D. D点溶液中:c(Cl-)+ 2c(H+)=2c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】有下列七种元素,试按下述所给的条件推断。
①A、B、C 是同一周期的金属元素,已知原子核外有 3 个电子层,A 的原子半径在所属周期中最大且原子半径:A>B>C。
②D、E 是非金属元素,它们跟氢气化合可生成气态氢化物 HD 和 HE;在室温时,D 的单质是液体,E 的单质是固体。
③F 在常温下是气体,性质稳定,是除氢气外最轻的气体。
④G 是除氢外原子半径最小的元素(不考虑稀有气体)。
(1)F 的元素符号是_________。A 的名称是_________;B 位于周期表中第_________周期_________族;C的原子结构示意图为__________。
(2)E单质的颜色是_________。
(3)A元素与D元素形成的化合物的电子式为_________。
(4) 用电子式表示 G与A形成化合物的过程 : _________。
(5)在上述七种元素中,最高价氧化物对应水化物的碱性最强的是__________(填化学式下同),气态氢化物最稳定的是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素 A、B、C、D 的原子序数依次增大,其中 C 为金属元素,A、C 的最外层电子数相等;C、D 两元素原子的质子数之和为 A、B 两元素质子数之和的 3 倍。
(1)写出 A、B、C、D 的元素符号:A_________,B_________,C_________,D_________ 。
(2)A、B、C、D 的原子半径大小顺序为 _________。
(3)A 和 C 形成化合物 CA 的电子式为_________。
(4) 用电子式表示C与D形成化合物 C2D 的 过 程 : _________。
查看答案和解析>>
科目: 来源: 题型:
【题目】柠檬酸(用HR 表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的含量随pH的变化如图所示。下列说法正确的是
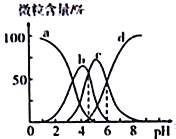
A. H3R的第二步电离常数Ka2(H3R)的数量级为10-4
B. pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
C. Na2HR溶液中HR2-的水解程度大于电离程度
D. pH=4时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A.恒温恒容密闭容器中反应:H2NCOONH4(s) ![]() 2NH3(g)+CO2(g),混合气体的压强不再改变时说明反应已达平衡
2NH3(g)+CO2(g),混合气体的压强不再改变时说明反应已达平衡
B.汽车尾气催化净化时的反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) ΔH < 0 ,平衡常数为K1;若反应在绝热容器中进行,平衡常数为K2;则K1 < K2
N2(g)+2CO2(g) ΔH < 0 ,平衡常数为K1;若反应在绝热容器中进行,平衡常数为K2;则K1 < K2
C.某恒容密闭容器中反应:nA(g)+mB(g)![]() pC(g)+qD(g) ΔH > 0已达平衡,则降温时c(B)/c(C)的值增大
pC(g)+qD(g) ΔH > 0已达平衡,则降温时c(B)/c(C)的值增大
D.2NO2(g) ![]() N2O4(g)在常温下即可进行,说明正反应是放热反应
N2O4(g)在常温下即可进行,说明正反应是放热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目: 来源: 题型:
【题目】甲~庚等元素在周期表中的相对位置如下表,己的最高价氧化物的水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
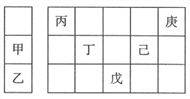
A. 丙与戊的原子序数相差25 B. 气态氢化物的稳定性:庚<己<戊
C. 丁的最高价氧化物可用于制造光导纤维 D. 常温下,甲和乙的单质能与水剧烈反应
查看答案和解析>>
科目: 来源: 题型:
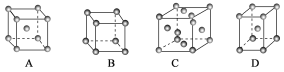
【题目】I.金属晶体中金属原子主要有三种常见的堆积方式,体心立方堆积、面心立方堆积和六方堆积。
(1)金属铜采用下列________(填字母代号)堆积方式。
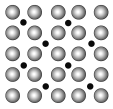
(2)洁净铁(可用于合成氨反应的催化剂)的表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则在图示状况下,铁颗粒表面上N/Fe原子数比值的最大值为________________。
II.已知A、B、C、D、E五种元素都是元素周期表中前20号元素,原子序数依次增大,E的外围电子排布式为4s2。A、B、C、D四种元素在元素周期表中的相对位置如下表所示。
…… | A | ||||||
B | C | D |
根据以上信息,回答下列问题:
(1)A和B的离子中,半径较小的是________(填离子符号)。
(2)A、D分别与B形成的化合物中,________的晶格能大(填化学式)。
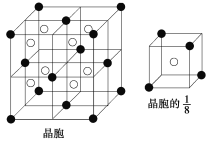
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示(阳离子用“●”表示,位于该正方体的顶点或面心;阴离子用“〇”表示,均位于小正方体中心)。该化合物的电子式是____________。A和E化合物的晶胞1/8的体积为2.0×10-23 cm3,求A和E组成的离子化合物的密度,请列式并计算(结果保留一位小数):__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com