
科目: 来源: 题型:
【题目】下列有关说法正确的是( )
A. 实验室制氢气,为了加快反应速率,可向稀硫酸中滴加少量硝酸铜溶液
B. 可用勒夏特列原理解释2NO2(g)![]() N2O4(g)体系加压后颜色变深
N2O4(g)体系加压后颜色变深
C. N2(g)+ 3H2(g)![]() 2NH3(g) ΔH<0可通过加压方式增大其平衡常数
2NH3(g) ΔH<0可通过加压方式增大其平衡常数
D. 二氧化硫和乙烯两种气体分别通入Br2的CCl4溶液,能使溶液褪色的是乙烯气体
查看答案和解析>>
科目: 来源: 题型:
【题目】SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径.

(1)利用电化学原理将CO、SO2转化为重要化工原料,装置如图1所示:
①若A为CO,B为H2,C为CH3OH,则通入CO的为_________极(填“正”或“负”)。
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为:___________________________。
(2)碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1∶1)直接做燃料,其工作原理如图2所示。
①电池总反应为____________________________________________。
②以此电源电解足量的硝酸银溶液,若阴极产物的质量为21.6g,电解后溶液体积为2L,溶液的pH约为___________。
(3)某研究小组利用下列装置用N2O4生产新型硝化剂N2O5。

①现以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2。在该电极上同时还引入CO2的目的是__________________________。
②电解过程中,生成N2O5的电极反应方程式为_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、X均为中学常见的物质,它们之间有如下转化关系(反应条件及副产物已略去)。
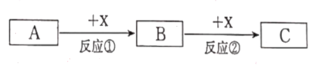
(1)若A和X均为单质,B为可使品红溶液褪色的气体,则反应②的化学方程式为____。
(2)若A、B、C为含钠元素的化合物,X为无色无味气体,则反应②的化学方程式为______ 。
(3)若A为稀硝酸,B溶液和硫氰酸钾溶液反应后溶液显红色,则反应②的离子方程式为_____。若向C的溶液中加入氢氧化钠溶液产生白色沉淀,在空气中迅速变成_____,最后变成_______,白色沉淀发生上述变化的原因 ______(用化学方程式表示)。56 g X与足量的稀硝酸发生反应,被还原的HNO3为__________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学电源在日常生活和工业生产中有着重要的应用。
I.如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题
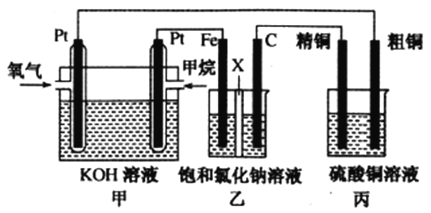
(1)甲烷燃料电池负极反应式是______________________。
(2)石墨(C)极的电极反应式为______________________。
(3)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁极上生成的气体体积为___________L;丙装置中阴极析出铜的质量为___________g,一段时间后烧杯中c(Cu2+)___________(填“增大”、“减小”或“不变”)
Ⅱ.“长征”火箭发射使用的燃料是液态偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分)。某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,回答相关问题:
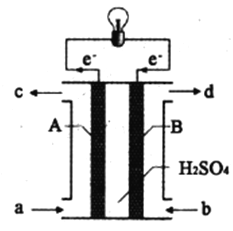
(4)从a口加入___________(填名称)。H+移动方向是___________(填“A到B”或“B到A”)
(5)A极发生的电极反应式:______________________。
(6)若以该电池为电源用石墨做电极电解200mL0.5mol/L的CuSO4溶液,电解一段时间后,两极收集到相同体积(相同条件)的气体,则整个电解过程转移的电子的数目是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。下列说法正确的是( )
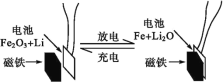
A.放电时,正极的电极反应式为Fe2O3+6Li++6e-=2Fe+3Li2O
B.该电池可以用水溶液作电解质溶液
C.放电时,Fe作电池的负极,Fe2O3作电池的正极
D.充电完成后,电池被磁铁吸引
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法或表示法正确的是( )
A.等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.使用催化剂的反应是吸热反应
C.在稀溶液中:H++OH﹣=H2O ΔH=﹣57.3 kJ·mol-1,若将含 1 molCH3COOH 的醋酸溶液与含 1 mol NaOH 的溶液混合,放出的热量小于 57.3 kJ
D.在 101 kPa 时,2 g H2 完全燃烧生成液态水,放出 285.8 kJ 热量,氢气燃烧的热化学方程式表示为 2H2(g)+O2(g)=2H2O(l)ΔH=+285.8 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】新型锌碘液流电池具有能量密度高、循环寿命长等优势,其工作原理如图所示。下列说法错误的是

A. 放电时电流从石墨电极流向锌电极
B. 充电时阳极反应式为:3I--2e-=I3-
C. 若将阳离子交换膜换成阴离子交换膜,放电时正负极也随之改变
D. 放电时左侧电解质储罐中的离子总浓度增大
查看答案和解析>>
科目: 来源: 题型:
【题目】铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法正确的是
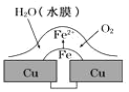
A.阳极电极反应式为:2H++2e→H2↑
B.此过程中电子从 Fe 移向 Cu,铁铆钉发生还原反应
C.此过程中铜会被腐蚀,发生氧化反应
D.此过程中铁做负极,被氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】向20 mL 0.40 mol/L H2O2溶液中加入少量KI溶液:ⅰ.H2O2+I-=H2O+IO﹣;ⅱ.H2O2+IO﹣= H2O+O2↑+ I﹣。H2O2分解反应过程中能量变化和不同时刻测得生成O2的体积(已折算标准状况)如下。

t/min | 0 | 5 | 10 | 15 | 20 |
V(O2)/mL | 0.0 | 12.6 | 20.16 | 28.0 | 32.7 |
下列判断不正确的是
A. 从图中可以看出,KI能增大H2O2的分解速率
B. 反应ⅰ是放热反应,反应ⅱ是吸热反应
C. 0~10 min的平均反应速率:v(H2O2)≈9.0×10-3 mol/(L·min)
D. H2O2在反应过程中既体现了氧化性,又体现了还原性
查看答案和解析>>
科目: 来源: 题型:
【题目】在不同电压下用惰性电极电解饱和NaCl溶液制备少量NaClO,实验结果如下:
实验 | ① | ② | ③ |
电压 | U1 | U2 | U3 |
现象 | a极产生少量气泡,b极无明显气泡 | a极产生较多气泡,b极产生少量气泡 | a极产生大量气泡,b极逸出大量黄绿色气体 |
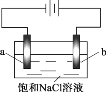
下列分析不正确的是
A. ①、②、③中,a极均发生了还原反应
B. ①、②、③中均能发生Cl2+2NaOH =NaCl+NaClO+H2O
C. 电解时OH- 由b极向a极移动
D. 不宜采用实验③的电压制备NaClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com