
科目: 来源: 题型:
【题目】己二酸是合成尼龙-66的主要原料之一。实验室合成己二酸的原理、有关数据如下:
3![]() +8HNO3→3
+8HNO3→3![]() +8NO↑+7H2O
+8NO↑+7H2O
物质 | 相对分子质量 | 密度(20℃) | 熔点 | 沸点 | 溶解性 |
环己醇 | 100 | 0.962 g/cm3 | 25.9℃ | 160.8℃ | 20℃时,在水中溶解度为3.6g,可混溶于乙醇、苯 |
己二酸 | 146 | 1.360 g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g。易溶于乙醇,不溶于苯 |
步骤Ⅰ:在如图装置的三颈烧瓶中加入16 mL 50%的硝酸(过量,密度为1.310 g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4 mL环己醇。

步骤Ⅱ:水浴加热三颈烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
步骤Ⅲ:当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10 min(注意控制温度),直至无红棕色气体生成为止。
步骤Ⅳ:趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后抽滤、洗涤、干燥、称重。请回答下列问题:
(1)装置b的名称为__________,使用时要从_________(填“上口”或“下口”)通入冷水;滴液漏斗的细支管a的作用是________________。
(2)实验中,先将温度由室温升至50℃左右,再慢慢控制在60℃~65℃之间,最后控制在80℃~90℃,目的是____________________。
(3)本实验所用的50%的硝酸物质的量浓度为____________;实验中,氮氧化物废气(主要成分为NO和NO2)可以用NaOH溶液来吸收,其主要反应为NO+NO2+2NaOH == 2NaNO2+H2O。其中NaOH溶液可以用Na2CO3溶液来替代,请模仿上述反应,写出Na2CO3溶液吸收的方程式:______________________________________。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水或______洗涤晶体。
(5)通过称量得到产物7.00 g,则本实验产率为__________(精确到0.1%)。
查看答案和解析>>
科目: 来源: 题型:
【题目】填写下表中的空格:
微粒符号 | 质子数 | 中子数 | 电子数 | 质量数 |
| _______ | ___________ | ____________ | _____________ |
________ | 18 | 20 | _______________ | __________ |
____________ | ___________ | 16 | 18 | 32 |
查看答案和解析>>
科目: 来源: 题型:
【题目】I.甲醛在木材加工、医药等方面有重要用途。甲醇直接脱氢是工业上合成甲醛的新方法,制备过程涉及的主要反应如下:
反应I:CH3OH(g) ![]() HCHO(g)+H2(g) △H1
HCHO(g)+H2(g) △H1
反应II:CH3OH(g)+1/2O2(g) ![]() HCHO(g)+H2O(g) △H2= —156.6kJ/mol
HCHO(g)+H2O(g) △H2= —156.6kJ/mol
反应III:2H2(g)+O2(g) ![]() 2H2O(g) △H3= —483.6kJ/mol
2H2O(g) △H3= —483.6kJ/mol
(1)计算反应I的反应热△H1=_____________。
(2)750K下,在恒容密闭容器中,发生反应CH3OH(g) ![]() HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________(用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________(用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
II. CO2既是温室气体,也是重要的化工原料,以CO2为原料可合成多种有机物。
(3)二氧化碳与氢气在催化剂作用下可制取低碳烯烃。在一恒容密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。

①其他条件不变,起始时若按1molCO2、2molH2进行投料,则CO2的转化率将________(填“增大”“ 减小”或“不变”)。
②△H______ (填“>”“<”或“不能确定”)0。
③若测试中体系内无氧气产生,试结合图示推断热稳定性:C2H4_________(填“>” “<”或“不能
确定”)H2O。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化见图1。在15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为______________(填序号)。
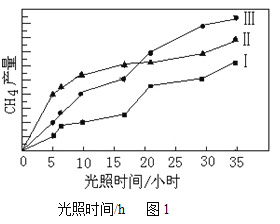
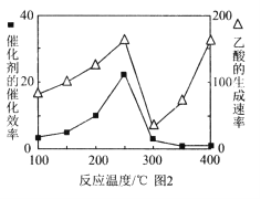
(5)以 TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图2。乙酸的生成速率主要取决于温度影响的范围是______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用下面的原子或离子结构示意图的编号(A、B、C、D)填空:
![]()
(1)电子层排布相同的是______________;
(2)属于同种元素的是________________;
(3)属于金属元素的是 ___________________;
(4)属于稀有气体元素的是______________,稀有气体一般不参加化学反应的原因是_______
(5)写出D参加化学反应后所得离子的结构示意图 _____________
查看答案和解析>>
科目: 来源: 题型:
【题目】按如图所示装置进行下列不同的操作,请回答有关问题:操作:①只接通K1;②只接通K2;③只接通K3;④都断开。
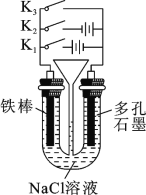
(1)铁棒的腐蚀速率由大到小的顺序是____(填操作序号)。
(2)原料粗盐中常含有泥沙和Ca2+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是_____(填序号)。
(3)若把U形管中的NaCl溶液换成100mL0.1mol/L的CuSO4溶液,且只进行操作②,则当电路中通过0.01mol电子时:(填“铁”或“石墨”)____电极增重_____g,此时溶液的pH=_____(忽略溶液体积变化)。
(4)若把U形管中的NaCl溶液换成加入了2molAgNO3、1molNa2SO4和1molBaCl2后的溶液,且只进行操作②,则装置中可观察到的现象为:____。通电一段时间后,氧化产物与还原产物的质量比为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D都是短周期元素,原子半径:D>C>A>B。已知A、B同周期,A、C同主族,C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的3倍。请回答下列问题:
(1)A元素在周期表中的位置:____;B、D两元素形成化合物的化学式:_________。
(2)元素B、C、D的简单离子半径的大小顺序:____________(用离子符号回答)。
(3)C、D两元素最高价氧化物对应水化物的碱性强弱关系: > (用化学式表示)。________
(4)B、C形成的化合物在D元素最高价氧化物对应水化物的溶液中反应的化学方程式:____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有位于前四周期的A、B、C、D、E、F六种元素,它们的核电荷数依次增大。其中C、E、F是金属元素;A和E属同族,它们原子的最外层电子排布式为ns1。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。F元素原子共有3个价电子,其中一个价电子位于第三能层d轨道。请回答下列问题:
(1)A是_____,B是_____,F是_____。(写元素符号)
(2)写出F元素基态原子的核外价电子排布图_____,其最高化合价为_____。
(3)含E元素的化合物灼烧的颜色是_____。很多金属盐都可以发生焰色反应,其原因是_____。
(4)请写出元素C的最高价氧化物对应的水化物与HClO4反应的离子方程式:_____。
(5)C与E的金属性强弱关系是C____E,请设计一个简单实验来证明:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有1个未成对电子,次外层有2个电子,其元素符号为____。
(2)B元素是前四周期基态原子中的未成对电子数最多的,其基态原子的价电子排布图为_____。
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,该电子的轨道形状为_____,C的基态原子核外电子占用了_____个原子轨道,被其占用的最外电子层本身有_____个能级。
(4)D元素是自然界中含量居第二位的金属元素,其+3价离子简化的核外电子排布式为______,该离子比同元素的其它离子更稳定的原因是_____。
(5)E元素原子最外层电子数是电子层数的3倍,其核外共有_____种能量不同的电子,写出E的具有18个电子的氢化物的电子式:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】四种短周期元素在周期表中的相对位置如图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。请回答下列问题:
X | Y | |
Z | W |
(1)元素Z位于周期表中第____周期____族。
(2)X、Y元素氢化物稳定性强弱顺序是____(用化学式表示)。
(3)Y、Z的最高价氧化物对应水化物的酸性强弱顺序是____(用化学式表示)。
(4)原子序数比Y多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是____ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素,W与O2反应能生成两种氧化物。
(1)写出W与O2反应的化学方程式:_________、_________。
(2)W与Y可形成化合物W2Y,该化合物的化学式为____,X与Z可形成化合物XZ2,该化合物的名称为____。
(3)比较Y、Z气态氢化物的稳定性:____>____(用化学式表示)。
(4)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是________(用化学式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com